1. INTRODUCCIÓN
El agua de los balnearios mineromedicinales no es estéril y posee una microbiota cuya diversidad y abundancia dependen de las condiciones biológicas, ecológicas, geológicas, microbiológicas y químicas de estos ecosistemas (1,2). Las observaciones de microorganismos en las aguas minerales comienzan a finales del siglo XIX en Europa, siendo España pionera en este campo, ya que los primeros estudios microscópicos de las aguas mineromedicinales de los que se tiene conocimiento fueron realizados en 1881, en el Balneario Caldas de Besaya, donde se observaron varios microorganismos como algas y hongos (3). Poco después ya había entre la clase médica una gran aceptación de la existencia de microorganismos autóctonos en estas aguas, ya que, en el I Congreso Hidrológico, celebrado en 1888, el Dr. García López comunicó que “los microorganismos de las aguas minerales influyen en la naturaleza química y en sus efectos terapéuticos” (4). Años más tarde, en 1897, se realizaron estudios microbiológicos más completos, como el efectuado en el agua del Balneario de Arbieto (Vizcaya), en el que se incluyeron recuentos e identificación de bacterias, además de las observaciones microscópicas de otros microorganismos (5).
De acuerdo con lo señalado por varios investigadores, la microbiota del agua mineromedicinal está constituida por dos tipos de microorganismos, muy diferentes en origen y en propiedades: Los autóctonos, que son los propios del hábitat y que constituyen la microbiota natural, y los alóctonos, procedentes de otro hábitat (suelo, heces y vegetales) y que se consideran contaminantes ocasionales (6,7,8).
De igual forma, se ha indicado que el principal componente de la microbiota de las aguas mineromedicinales lo constituye la población bacteriana (1,8), aunque se ha detectado la presencia de protozoos no patógenos y parásitos como Naegleria australiensis, Acanthamoeba astronyxis, Bodomorfa minima, Amoebae, Giardia y Cryptosporidium (9,10), así como virus (11).
Aunque son escasos los trabajos, también se ha señalado la presencia de hongos en las aguas mineromedicinales, los cuales, por lo general, suelen estar en número muy bajo, predominando los hongos filamentosos sobre las levaduras (12,13,14,15,16,17).
Las células de hongos pueden llegar a los manantiales de aguas mineromedicinales procedentes del suelo, fauna, vegetación y de los usuarios que utilizan estas aguas en sus terapias (7). De igual manera, las especies transportadas por el aire también pueden contribuir a la composición de la microbiota de estos ecosistemas (18).
Se ha prestado poca atención a la presencia de los hongos filamentosos y de las levaduras en el medio acuático, entre ellos los manantiales de aguas mineromedicinales (19,20), lo que hace necesario realizar investigaciones en esta área, ya que los hongos presentes en el agua podrían estar asociados con una variedad de efectos relacionados con enfermedades infecciosas y problemas organolépticos en el agua (18,21), sobre todo considerando que en los balnearios de aguas mineromedicinales el agua se administra por varias vías de aplicación como terapia en personas con problemas de salud y puede dar lugar a la adquisición de infecciones micóticas.
2. MATERIALES Y MÉTODO
2.1. Sitios de muestreo
Uno de los sitios donde se realizó parte de la investigación fue el balneario de aguas mineromedicinales de “Santagua de Chachimbiro”, ubicado en el suroeste de la parroquia Tumbabiro, en el cantón Urcuquí, provincia Imbabura, en la Cordillera Occidental Andina ecuatoriana (ver Figura 1), a una altitud de 2672 m s. n. m. y con una temperatura ambiente que varía entre los 16 y 22 °C. Las aguas termominerales de Chachimbiro, en el complejo Santagua, provienen de un acuífero hidrotermal profundo. El agua termal de este balneario se ha determinado que es de tipo clorurada sódica e hipertermal, ya que la temperatura media del agua es de 55 °C (22).
Figura 1. Ubicación geográfica del balneario “Santagua de Chachimbiro”. Imbabura. Ecuador (Google Maps, 2025).
Otro de los sitios donde se desarrolló el estudio fue en el balneario mineromedicinal de “Termas de Jamanco”. Está localizado al nororiente de Ecuador, provincia de Napo, cantón Quijos, parroquia Papallacta, Ecuador (ver Figura 2). Está a una altitud de 3400 m s. n. m., con una temperatura ambiental promedio de 8 °C y una precipitación media anual mayor a 1000 mm. (23). Las aguas de este balneario han sido clasificadas como de tipo cloruradas sódicas con temperaturas de 49,8 °C, consideradas como hipertermales (23).
Figura 2. Ubicación geográfica del balneario “Termas de Jamanco”. Napo. Ecuador (Google Maps, 2025).
El último de los sitios donde se llevó a cabo la investigación fue en el balneario de aguas mineromedicinales “Termas de Santa Ana”, ubicado en el cantón de Baños de Agua Santa de la provincia de Tungurahua, Ecuador (ver Figura 3), a una altitud de 2031 m s. n. m., con una temperatura ambiental promedio de 20 °C. Las aguas mineromedicinales termales del balneario “Santa Ana” son de tipo sulfatadas, magnésicas e hipertermales por tener una temperatura promedio de 35 °C (23).
Figura 3. Ubicación geográfica del balneario “Termas de Santa Ana”. Tungurahua. Ecuador (Google Maps, 2025).
2.2. Muestras
En el balneario de “Santagua de Chachimbiro”, los puntos de la toma de muestra fueron cuatro. El primero fue en la vertiente o emergencia del agua. El segundo, en el tanque de almacenamiento. El tercer y cuarto punto fueron del agua de las piscinas termales del balneario. En todos los casos se tomó un volumen de 1 litro de muestras de agua, por duplicado en cada ocasión. Se realizaron dos muestreos en cada punto establecido, con un total de 16 muestras.
Para el balneario “Termas de Jamanco”, los sitios de muestreo fueron 6. Las tres piscinas termales del complejo, el tanque de almacenamiento y las dos vertientes o nacientes de donde se toma el agua para el balneario. El volumen de muestra en cada sitio fue de 1 litro de muestras de agua, recolectadas por duplicado. Se realizaron dos muestreos, con un total de 24 muestras.
Respecto al balneario “Termas de Santa Ana”, se seleccionaron 3 sitios de muestreo: la naciente del agua, el tanque de almacenamiento del agua y la piscina termal del balneario. El volumen de muestra en cada sitio de muestreo fue de 1 litro de agua, recolectada por duplicado. Se realizaron dos muestreos, con un total de 12 muestras.
En todos los casos, los muestreos se realizaron de acuerdo con la norma ecuatoriana sobre muestras de agua, transportándose las muestras hasta el laboratorio de análisis según lo indicado en la normativa (24).
Medios de cultivo
Los medios de cultivo utilizados se prepararon a partir de las formas deshidratadas suministradas por las casas comerciales o mezclando los constituyentes del medio, de acuerdo con la fórmula correspondiente. Se emplearon los medios de cultivo agar Sabouraud (OxoidTM) con cloranfenicol al 0,05% y las placas CompactDryTM para mohos y levaduras.
2.3. Metodología
2.3.1. Recuento y aislamiento de especies de hongos filamentosos y levaduras.
Para la cuantificación y aislamiento de los hongos filamentosos y las levaduras se empleó la técnica de filtración en membrana (25). Se filtraron por duplicado 100 mL de la muestra de agua, empleando filtros Millipore de 0,45 µm de poro que se depositaron en placas con medio de cultivo conteniendo agar Sabouraud con cloranfenicol al 0,05% y placas CompactDryTM, las cuales se incubaron a 24°C de 7 a 14 días. Al finalizar el período de incubación, se contaron las colonias típicas de hongos filamentosos y levaduras y se expresó el resultado en Unidades Formadoras de Colonias por 100 mililitros de agua (UFC/100 mL). Las colonias se repicaron en agar Sabouraud para su posterior identificación.
2.3.2. Identificación de las colonias fúngicas aisladas
Se eligieron varios tipos de colonias de hongos para identificarlas según sus características visibles y microscópicas, y también según qué tan a menudo fueron detectadas. Las identificaciones se basaron en los esquemas propuestos por Pitt & Hocking (26).
3. RESULTADOS Y DISCUSIÓN
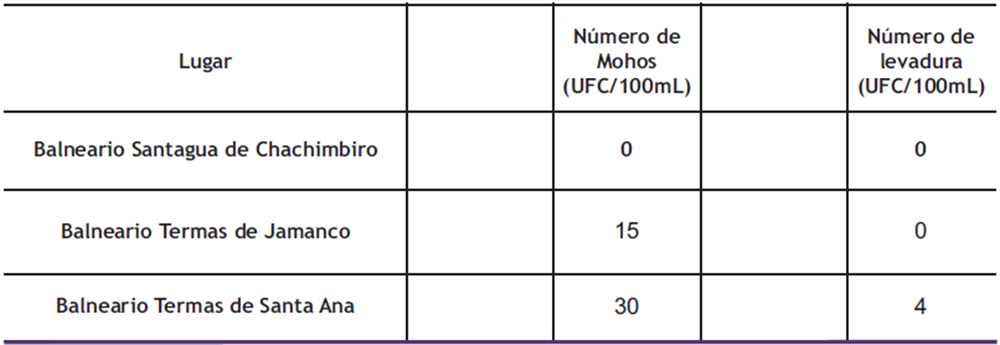
En el presente estudio se ha detectado un número muy bajo de hongos filamentosos y levaduras, no mayor a 34 UFC/100 mL, en el agua de los balnearios investigados (ver Tabla 1).
El balneario donde se detectó un mayor número de hongos filamentosos (30 UFC/100 mL) fue el balneario “Termas de Santa Ana”, ubicado en la provincia de Tungurahua, y en el balneario “Santagua de Chachimbiro”, ubicado en la provincia de Imbabura, no se evidenció la presencia de mohos y levaduras en ninguna de las muestras (Ver Tabla 1).
La cuantificación de la población fúngica en agua mineral natural es poco frecuente, ya que las normativas internacionales que regulan la calidad de este tipo de agua no lo establecen dentro de sus parámetros de análisis (21,27).
Tabla 1. Valores promedios de la cuantificación de mohos y levaduras del agua de balnearios mineromedicinales de Ecuador.
Los valores observados en las muestras de agua de cada uno de los balnearios investigados no superan a los indicadores de la cantidad de UFC/L adoptados en la normativa de Suecia (16,21), uno de los pocos países con normas sobre este parámetro.
En Ecuador, como en la mayoría de los países, no existen valores límites micológicos para la evaluación de la calidad del agua mineromedicinal.
Los valores obtenidos en la cuantificación de hongos filamentosos y levaduras han sido similares a los indicados por otros autores (13,14,15,28).
Los hongos son más frecuentes en las aguas dulces que en las saladas; en las aguas naturales poco contaminadas predominan los hongos filamentosos y en las contaminadas, las levaduras. Estos microorganismos pueden vivir de la descomposición de residuos vegetales y su presencia, en número alto, indica una contaminación del agua con microorganismos y restos vegetales procedentes del suelo (1,2,7,18). En este sentido, y según los resultados de la cantidad de hongos filamentosos y levaduras, se puede decir que el agua de los balnearios estudiados no representaría un riesgo para la transmisión de infecciones por hongos.
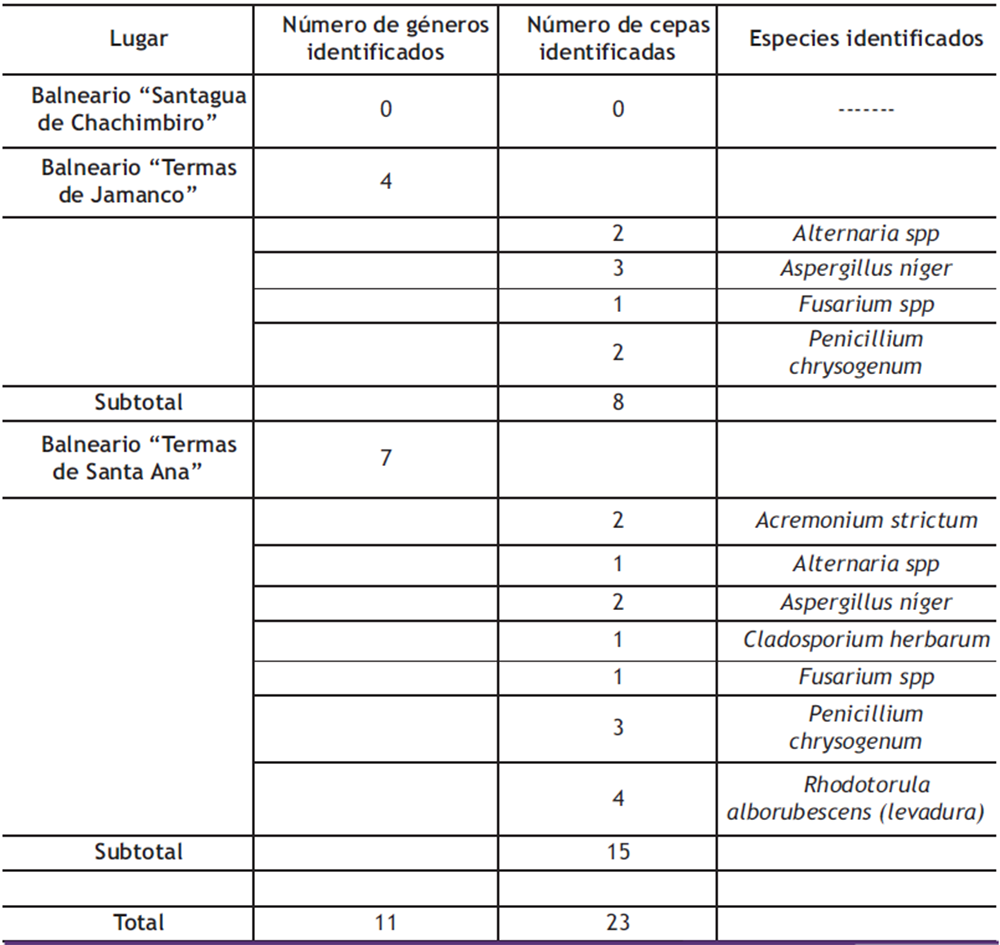
Se han podido aislar e identificar colonias fúngicas pertenecientes a la división de Ascomicetes correspondientes a 6 especies: Acremonium strictum, Alternaria spp., Aspergillus niger, Cladosporium herbarum, Fusarium spp. y Penicillium chrysogenum, perteneciendo el mayor número de cepas a los géneros Penicillium y Cladosporium (ver Tabla 2), resultados similares a lo encontrado por autores en otras partes del mundo (14,15,16,21,29,30,31).
De igual forma, se pudieron aislar e identificar cuatro colonias de levaduras, las cuales resultaron pertenecer a la especie Rhodotorula alborubescens (ver Tabla 2).
El aislamiento de colonias de hongos filamentosos ha sido superior al de las levaduras, las cuales solo se pudieron detectar y cuantificar en el agua del balneario “Termas de Santa Ana” (Ver Tabla 2).
Tabla 2. Especies de hongos filamentosos y levaduras aislados e identificados
Las principales especies de hongos filamentosos aislados corresponden a grupos cosmopolitas, muy ubicuos en la naturaleza y cuyo aislamiento se ha señalado por otros autores en manantiales de aguas mineromedicinales y envasadas (24,30,32,33).
Frankova y Horecka (1995) señalan el aislamiento de 39 géneros y 64 especies de hongos en 294 muestras de aguas de manantiales y pozos cercanos a la ciudad de Bratislava, resultado diferente a lo obtenido en la presente investigación, donde el número y la diversidad de géneros ha sido muy inferior (34).
En un estudio en Westphalia, Alemania, se encontraron especies de los géneros Acremonium, Penicillium y Phialophora en aguas de manantiales (35), resultados similares a los de las aguas de los balnearios ecuatorianos que se analizaron.
En un estudio en Colombia sobre agua mineral embotellada (36), se encontró que el 30% de las muestras tenía células de hongos, con conteos de UFC/mL entre 0 y 67, siendo las especies más comunes del género Penicillium. Estos resultados son parecidos a los obtenidos en esta investigación.
Se ha sugerido que la poca frecuencia de aislamiento de hongos en las aguas minerales naturales se debe a la competencia entre esta comunidad de hongos y la población de bacterias que también está presente (7). En una serie de experimentos en Japón, se demostró que las esporas de hongos comunes en aguas minerales naturales pueden germinar en este ambiente. Sin embargo, su supervivencia depende de las condiciones físico-químicas y microbiológicas del agua (12).
Las aguas mineromedicinales presentan ciertas condiciones fisicoquímicas específicas a las que los hongos deben adaptarse. Se caracterizan por ser oligotróficas, tener altas temperaturas, un suministro limitado de oxígeno y pocas sustancias orgánicas, pero pueden contener un mayor contenido de compuestos inorgánicos que en las aguas superficiales. Sin embargo, en las aguas mineromedicinales se encuentran mínimas cantidades de mono o polisacáridos, principalmente provenientes de restos de biopelículas bacterianas presentes en los tapetes microbianos (1,2,7).
También se han reportado algunos casos de contaminación por hongos en aguas minerales embotelladas (37), donde se ha visto crecimiento micelar, aunque este tipo de problema no es común.
Es importante indicar que, en el caso de las aguas de los balnearios mineromedicinales, aguas que son utilizadas como medicamentos, la presencia de células de hongos podría tener implicaciones en la salud de los usuarios (16,38). Por tanto, es importante llevar a cabo investigaciones para conocer los riesgos existentes, que, en el caso del agua de los balnearios ecuatorianos investigados en el trabajo, han sido muy bajos.
4. CONCLUSIONES
Se logró identificar y medir la cantidad de varios tipos de hongos filamentosos y levaduras en las aguas de los balnearios mineromedicinales estudiados, aunque en cantidades muy bajas, lo que sugiere que estas aguas están poco contaminadas por hongos.
No se detectó la presencia de hongos filamentosos y levaduras en el agua del balneario “Santagua de Chachimbiro”.
Se lograron aislar e identificar colonias de hongos filamentosos de varios géneros del grupo de los ascomicetos, así como levaduras del género Rhodotorula.
La presencia de hongos en el agua sugiere la necesidad de realizar monitoreos periódicos para garantizar la calidad sanitaria del agua y la salud de los usuarios.
Agradecimientos
Nuestro agradecimiento a la Dirección de Investigación de la Universidad Central del Ecuador por el apoyo brindado mediante el financiamiento otorgado a través del proyecto DI-2022-045.
Conflicto de intereses
Se deja constancia de que ninguno de los autores presenta conflicto de intereses con la investigación realizada y los resultados obtenidos.
5. BIBLIOGRAFÍA
- De la Rosa MC, Mosso MA. Diversidad microbiana de las aguas minerales termales. En: Panorama actual de las aguas minerales y mineromedicinales de España. Ed. A. López y JL.
- Pinuaga. Instituto Tecnológico Geominero de España. 2000. Madrid. (España), pp. 153-158.
- Gómez F. Hot Spring Microbiology. In: Gargaud, M. Encyclopedia of Astrobiology. Springer, Berlín, Heidelberg (Alemania). 2011. https://doi.org/10.1007/978-3-642-11274-4_74
- Moreno E. Importancia de la microscopía en el estudio de las aguas mineromedicinales. An. Soc. Esp. Hidro. Med. 1882; Tomo III: 24.
- Martínez-Reguera L. Bibliografía hidrológico-médico española. 2.ª parte. Tomo 1 y 2. Establec. Tip. Sucesiones de Rivadeneyra. Madrid. (España). 1896-1897.
- De la Rosa MC, Mosso A. Historia de las aguas mineromedicinales en España. Observatorio medioambiental. 2004; (7), 117-137. https://revistas.ucm.es/index.php/OBMD/article/view/OBMD0404110117A
- Schmidt-Lorenz W. Microbiological characteristics of natural mineral waters. Ann. Ist. Super. Sanita. 1976: 12: 93-112.
- Andueza, F. Diversidad microbiana de las aguas mineromedicinales de los balnearios de Jaraba. Tesis doctoral. Universidad Complutense de Madrid. Madrid. España. 2007.
- Savio D, Stadler P, Reischer GH, Kirschner AKT, Demeter K, Linke R, Blaschke AP, Sommer R, Szewzyk U, Wilhartitz IC, Mach RL, Stadler H, Farnleitner AH. Opening the black box of spring water microbiology from alpine karst aquifers to support proactive drinking water resource management. WIREs Water. 2018; 5(3): e1282. https://doi.org/10.1002/wat2.1282
- Nichols R, Campbell B, Smith H. Identification of Cryptosporidium spp. oocysts in United Kingdom noncarbonated natural mineral waters and drinking waters by using a modified nested PCR-restriction fragment length polymorphism assay. Appl. Environ. Microbiol. 2003; 69: 4183-4189.
- Lalaguaña Zamora CM, Pico Puebla AM. Determinación de Acanthamoeba spp. y Naegleria fowleri mediante un análisis fenotípico en aguas termales de la provincia de Pichincha-Ecuador. Tesis de pregrado. Universidad Central del Ecuador. Quito. Ecuador. 2019.
- Felipe Benites L, Stephens TG, Van Etten J, James T, Christian WC, Barry K, Grigoriev IV, McDermott TR, Bhattacharya D. Hot Spring viruses at Yellowstone National Park have ancient origins and are adapted to thermophilic hosts. Commun. Biol. 2024; 7: 312. https://doi.org/10.1038/s42003-024-05931-1
- Fujikawa H, Aketagawa J, Nakazato M, Wauke T, Tamura H, Morozumi S, Itoh T. Growth of moulds inoculated into commercial mineral water. Lett. Appl. Microbiol. 1999; 28: 211-215.
- Mosso MA, Sánchez M, De la Rosa MC. Microbiología del agua mineromedicinal de los balnearios de Alhama de Granada. Anal. Real Acad. Nac. Farm. 2002; 68: 381-405.
- De la Rosa MC, Andueza F, Sánchez A, Rodríguez M, Mosso M. Microbiología de las aguas mineromedicinales de los balnearios de Jaraba. Anal. Real Acad. Farm. 2004; 26: 521-542.
- Flores S. Aislamiento, identificación y detección de microorganismos con actividades biológicas procedentes de las aguas de los manantiales termales La Mitisusy Santa Apolonia del Estado
- Mérida. Tesis de maestría. Postgrado de Química de medicamentos. Facultad de Farmacia y Bioanálisis. Universidad de los Andes. Mérida. Venezuela. 2012.
- Babič M, Zalar P, Ženko B, Džeroski S, Gunde-Cimerman N. Yeasts and yeast-like fungi in tap water and groundwater, and their transmission to household appliances. Fungal Ecol. 2016; 20: 30–39.
- Oza Y, Karande M, Ghosh R, Rawat JM, Purohit S, Rawat B, Zumla A, Sharma A. Microbial diversity associated with the natural spring water of Western Himalayas. Vegetos. 2024; 37: 1795–1803. https://doi.org/10.1007/s42535-024-00942-z
- Jones EBG, Hyde KD, Pang KL, Freshwater Fungi and Fungal-Like Organisms. Walter de Gruyter GmbH, 2014. Berlín (Alemania).
- Dogget MS. Characterization of fungal biofilms within a municipal water distribution system. Applied and Environmental Microbiology. 2000; 66: 1249–1251.
- Hageskal G, Gaustad P, Heier BT, Skaar I. Occurrence of molds in drinking water. Applied and Environmental Microbiology. 2007; 102 (3): 774–780.
- Kurakov AV, Shumakova AA, Fedorova MD. Fungi in Groundwater Springs and Wells in Moscow Region. Biology Bulletin. 2024; 51(1): 78-90.
- Carrera Villacrés D., Guevara García P. Fuentes termales del Ecuador. Escuela Superior Politécnica del Ejército (ESPE). Quito. Ecuador. 2017.http://repositorio.espe.edu.ec/xmlui/handle/21000/11739.
- Burbano N, Becerra S, Pasquel E. Aguas termominerales en el Ecuador. INAMHI. Quito. Ecuador. 2013. https://issuu.com/inamhi/docs/termalismo
- Instituto Ecuatoriano de Normalización (INEN). NTE INEN 2 169-98 Agua. Calidad del agua. Muestreo. Manejo y conservación de muestras. Instituto Ecuatoriano de Normalización. Quito (Ecuador). 1998. https://doi.org/10.1134/S1062359023601908
- American Public Health Association. Standard methods for the examination of water and wastewater. 23rd Washington DC. (USA). 2017.
- Pitt JL, Hocking AD. Fungi and food spoilage. Blackie Academic and Professional. London. (UK). 2009.
- Unión Europea (UE). Directiva 2009/54/CE del Parlamento Europeo y del Consejo de 18 de junio de 2009 sobre explotación y comercialización de aguas minerales naturales. Diario Oficial de la Unión Europea. 2009. Disponible en: https://www.boe.es/doue/2009/164/L00045-00058.pdf
- De la Rosa MC, García CP, Fernández CR, García VF. Microbiología del agua mineromedicinal del Balneario de San Nicolás. Anal. Real Acad. Farm. 2018: 83(5): 63-78. https://analesranf.com/wp-content/uploads/2017/83_ex/83ex_04.pdf
- Hussain T, Ishtiaq MC, Hussain A, Mehmood T, Sultana K, Ashraf M. Incidence of fungi in water springs of Samahni Valley, District Bhimber, Azad Kashmir, Pakistan. Int. J. Biol. 2010; 2(2): 94.
- Salano OA, Makonde HM, Kasili RW, Boga HI. Isolation and characterization of fungi from a hot spring on the shores of Lake Bogoria, Kenya. Journal of Yeast and Fungal Research. 2018; 9(1): 1-13. https://doi.org/10.5897/JYFR2018.0182
- Wurzbacher C, Kreiling AK, Svantesson S, Den Wyngaert S, Larsson E, Heeger F, Nilsson H, Palsson S. Fungal communities in groundwater springs along the volcanic zone of Iceland, Inland
- Waters 2020; 10 (3): 418–427. https://doi.org/10.1080/20442041.2019.1689065
- Yamaguchi MU, Rampazzo RCP, Yamada-Ogatta SF, Nakamura CV, Ueda-Nakamura T, Filho BPD. Yeasts and filamentous fungi in bottled mineral water and tap water from municipal supplies. Braz. Arch. Biol. Technol. 2007:50: 1–9. https://doi.org/10.1590/S1516-89132007000100001
- Wang X, Pecoraro L. Diversity and co-occurrence patterns of fungal and bacterial communities from alkaline sediments and water of Julong high-altitude hot springs at Tianchi volcano,
- Northeast China. Biology 2021; 10(9), 894. https://doi.org/10.3390/biology10090894
- Frankova E, Horecka M. Filamentous soil fungi and unidentified bacteria in drinking water from wells and water mains near Bratislava. Microbiol. Res. 1995; 150(3):311-3.
- Gottlich E, van der Lubbe W, Lange B, Fiedler S, Melchert I, Reifenrath M, Flemming HC, de Hoog S. Fungal flora in groundwater-derived public drinking water. Int J Hyg Environ Health. 2002; 205:269-79.
- Arévalo-Pérez EC, Martínez-León AJ, Lemus-Pérez MF, Rodríguez-Susa MS. Aproximación a la presencia de SPD y microorganismos en agua embotellada. Tecnología y ciencias del agua. 2014; 5(2): 05-18.
- Cabral D, Fernández P. Fungal spoilage of bottled mineral water. J. Food Microbiol. 2002; 30: 73-76.
- Anaissie EJ, Stratton SL, Dignani MC, Lee C, Summerbell RC, Rex JH. Pathogenic molds (including Aspergillus species) in hospital water distribution systems: a 3-year prospective study and clinical implications for patients with hematologic malignancies. Blood 2003; 101: 2542–2546.