1. INTRODUCCIÓN
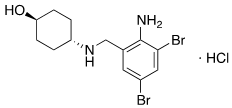
Clorhidrato de ambroxol o clorhidrato de trans-4-(2-amino-3,5-dibromobencilamino)-ciclohexanol (figura 1. Derivado sintético de la vasicina, el principio activo extraído del arbusto conocido como Adhatoda vasica (familia Acanthaceae) (1). Es un mucolítico con acción expectorante, utilizado en el manejo de los procesos bronquiales donde se requiere la movilización de las flemas (2).
Clorhidrato de clembuterol o clorhidrato de 1-(4-amino-3,5-diclorofenil)-2-(terc-butilamino)etanol (figura 2) se utiliza como broncodilatador en el tratamiento de la obstrucción reversible de las vías respiratorias, como en el asma y en ciertos pacientes con enfermedad pulmonar obstructiva crónica (3). También se le denomina agente de repartición, en virtud de que fomenta la producción de proteína y reduce la grasa (4).
Para el desarrollo químico-farmacéutico de un nuevo medicamento, es imprescindible la utilización de metodologías analíticas que permitan cuantificar el producto mayoritario en forma de materia prima o como ingrediente activo de una formulación (5). Generalmente, las metodologías analíticas aparecen en los documentos oficiales. De no encontrarse en dichos documentos, es necesario desarrollar el método analítico.
Una vez desarrollada la metodología analítica, es necesario garantizar que la misma proporcionará resultados confiables; es por ello que se debe proceder a validar el método. Para que un procedimiento pueda ser validado, es necesario considerar las recomendaciones sugeridas en textos oficiales; entre ellos destaca la USP 42, específicamente en el capítulo <1225> “Validación de los procedimientos farmacopéicos” (6). Los procedimientos para la validación de métodos analíticos según la USP están directamente relacionados con las pautas establecidas en la Conferencia Internacional de Armonización (ICH), específicamente en el texto “Validación de procedimientos analíticos: texto y metodología” Q2 (R1) (7).
Al consultar la Farmacopea de los Estados Unidos (USP), no se encontró ninguna metodología analítica para la determinación simultánea de ambroxol y clembuterol en jarabes. Lin y colaboradores en 2007 reportaron un método para la determinación de ambroxol y clembuterol en muestras de plasma humano, mediante extracción líquido-líquido. El ambroxol se separó en una columna Zorbax XDB-C18 y se detectó usando espectrometría de masas en tándem con una interfaz de ionización química a presión atmosférica, después de tomar por vía oral una preparación compuesta. El clembuterol se separó en una columna Zorbax XDB-C8 y se detectó mediante espectrometría de masas en tándem, con una interfaz de ionización por electrospray (8). En 2014, Acosta y Nina reportaron una metodología analítica para la determinación de ambroxol y clembuterol de manera separada. Las condiciones cromatográficas reportadas por estos autores para la determinación de clorhidrato de ambroxol fueron las siguientes: Columna Eclipse XDB – (L1) C18, de 100 mm x 4,6 mm x 5,0 µm, la fase móvil compuesta por acetonitrilo:buffer fosfato de amonio pH 7,0 (60:40), con un flujo de 1,0 mL/minuto, temperatura de 25°C, la longitud de onda fijada en el detector UV fue de 248 nm y el volumen de inyección de 10 µL, el tiempo de retención fue de aproximadamente 2,35 minutos, estableciéndose un tiempo de carrera de 5 minutos y para clembuterol utilizaron una Columna Purospher Star RP8e (L7), de 75 mm x 4,6 mm x 3,0 µm, fase móvil compuesta por acetonitrilo:tampón formato de amonio pH 2,7 (10:90), flujo de 1,0 mL/minuto, temperatura de 40 °C, longitud de onda de 296 nm, volumen de inyección de 80 µL, el tiempo de retención 10,5 minutos, tiempo de carrera de 40 minutos (9). En 2017, Morales Coronado analizaron una preparación de estándares separados de clembuterol y ambroxol, encontrando que la mejor proporción de la fase móvil a usar debería ser 70 % etanol y 30 % de buffer de ácido trifluoroacético 2,8 mM, con la que se obtuvo buena separación y tiempos de retención aceptables. Sin embargo, al aplicar la metodología analítica propuesta al análisis del medicamento, no logró obtener resultados satisfactorios, ya que no es adecuada para concentraciones de clembuterol en jarabe menores a 0,24 mg/100 mL (10). Este medicamento es ampliamente utilizado en Venezuela y se adquiere sin receta médica. Por lo tanto, es necesario desarrollar y validar un método analítico por HPLC para medir al mismo tiempo ambroxol y clembuterol en jarabe, asegurando que el medicamento cumpla con los estándares de calidad requeridos para los pacientes.
En este trabajo se presenta una metodología analítica y su validación para la determinación simultánea de ambroxol y clembuterol, empleando la técnica analítica HPLC acoplada a un detector de arreglo de diodos (PDA).
Figura 1. Estructura química de clorhidrato de ambroxol
Figura 2. Estructura química de clorhidrato de clembuterol
2. MATERIALES Y MÉTODOS
Para la validación de la metodología se utilizó un cromatógrafo líquido de alta eficiencia de la casa comercial Waters, conformado por una bomba modelo 600E, un inyector automuestrador, modelo 717 de Plus, un detector de red de diodos, modelo PDA 996. El cromatógrafo está conectado a un computador con un programa Millenium 32®. Se utilizó una columna Xterra C18 3,5 µm, 4,5 x 100 mm (di x L). Las condiciones experimentales del cromatógrafo líquido fueron las siguientes: fase móvil compuesta por acetonitrilo grado HPLC, 100% de pureza, de Mallinckrodt ChromAR, metanol grado HPLC 99,9% de pureza de Merck KgaA, solución amortiguadora/par iónico (KH2PO4 y ácido 1-octanosulfónico, pH 3,0 ajustado con H3PO4) en composición (15:20:65) % v/v a pH de 3,70, un flujo de fase móvil de 1,5 mL/min, un volumen de inyección de 15 µL y una longitud de onda de absorción de 245 nm.
Las mediciones de pH fueron realizadas con el potenciómetro Orion Research modelo 601 A. El agua utilizada para todos los análisis proviene del equipo de destilación Cascada Ro Waters (Pall Corporation) y es purificada en el ultrapurificador de agua Barnstead (Nanopure). Todas las muestras fueron filtradas antes de ser inyectadas en el cromatógrafo con membranas de filtración Millipore de nylon, tamaño de poro de 0,45 μm.
2.1 Estándares de referencia
Se emplearon estándares de referencia secundarios de clorhidrato de ambroxol, pureza = 99,5% de la casa fabricante Baselux S.A. y clorhidrato de clembuterol, pureza = 100,91% de la casa fabricante Planehill LTD. Ambos se encontraban vigentes durante toda la investigación.
2.2 Muestras
La muestra empleada para la validación de este método consistió en un jarabe cuyo contenido era 120 mL. En el rótulo se encontraba declarado que cada 5 mL de jarabe contenía 10 µg de clembuterol y 15 mg de ambroxol; para ello se seleccionaron 5 frascos del jarabe, del mismo lote, y se mezclaron cuidadosamente hasta obtener una muestra homogénea. Una vez culminada la validación, se adquirió otro medicamento, de diferente número de lote, con el propósito de aplicar la metodología analítica propuesta. Ambos medicamentos fueron fabricados y adquiridos en Venezuela; se emplearon antes de alcanzar la fecha de caducidad.
2.3 Validación del método analítico
La validación del método analítico se realizó siguiendo los lineamientos establecidos en el capítulo general <1225> de la USP 42 (6) e ICH Q2 (R1) (7). Los parámetros evaluados corresponden específicamente a la categoría I para la cuantificación de ambroxol y clembuterol; estos son: linealidad, precisión (precisión del sistema cromatográfico, repetibilidad y precisión intermedia), especificidad y exactitud.
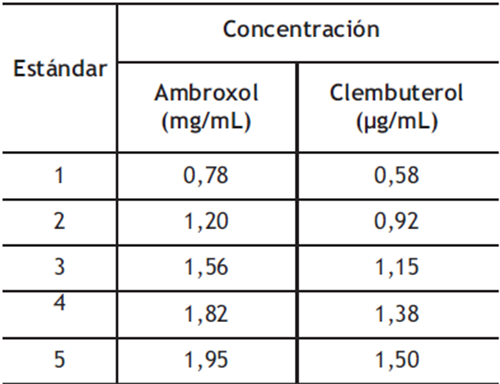
Linealidad: El estudio de la linealidad del método se basó en la construcción de curvas de calibración. Estas fueron realizadas en días diferentes a partir de cinco niveles de concentración correspondientes a 50, 80, 100, 120 y 130% del valor de referencia de acuerdo a la concentración del fármaco, tanto para el ambroxol como para el clembuterol. Estas disoluciones se prepararon a partir de los correspondientes estándares de referencia y los porcentajes están expresados en términos de niveles con respecto al 100% de la curva de calibración, como especifica la USP. Los cinco niveles de concentración mencionados abarcan desde 0,78 mg/mL hasta 1,95 mg/mL para el ambroxol y desde 0,576 µg/mL hasta 1,4976 µg/mL para el clembuterol en la fase móvil. Finalmente, se inyectó en el cromatógrafo cada estándar por duplicado. Se calculó la ecuación de regresión lineal para cada analito y se hicieron sus curvas de calibración al graficar el área de la señal cromatográfica frente a la concentración del analito correspondiente, así como los coeficientes de variación de los factores de respuesta.
Precisión: Se evaluó a través de la precisión del sistema cromatográfico, repetibilidad y precisión intermedia.
Para el estudio de la precisión del sistema cromatográfico, se realizaron 5 inyecciones de estándar al 100% (1,56 mg/mL de ambroxol y 1,15 μg/mL de clembuterol); posteriormente, se determinó el promedio del área bajo la curva de las señales cromatográficas obtenidas y el tiempo de retención, y se calcularon los coeficientes de variación (CV) utilizando la (ecuación 1).
CV (%) = (s/x–) * 100
Donde s corresponde a la desviación estándar y x– al promedio del área de las señales cromatográficas obtenidas.
La repetibilidad se evaluó analizando seis muestras a la concentración del 100% y determinando las cantidades de ambroxol y clembuterol presentes en ellas, utilizando la curva de calibración. La repetibilidad del método analítico se determinó mediante el cálculo del promedio y CV de las seis muestras, según lo establecido en la ICH, así como el cálculo de los intervalos de confianza (ecuación 2).
x– ± t x s/√n
Donde x– = promedio de la serie de resultados obtenidos en un mismo nivel de concentración.
t = valor t de Student según las tablas, para n-1 grados de libertad y α=0,05.
n = número de análisis
s = desviación estándar
Para el estudio de la precisión intermedia, se analizaron muestras al 100% en diferentes días, un solo analista y utilizando el mismo equipo. Se determinaron los valores promedio, s y CV.
También se usó el criterio de aceptación para la precisión intermedia, que se basa en el coeficiente de variación de Horwitz (11). (ecuación 3).
CVH (%) = 2 (1-0.5) log C
Donde: C = valor nominal del analito expresado en potencia de 10.
El coeficiente de variación de Horwitz debe ser comparado con el coeficiente de variación obtenido de las nueve determinaciones realizadas, mediante el parámetro Horrat (11). (ecuación 4).
PHorrat = CV/CVH
Si el PHorrat es menor a 2, se puede afirmar que el método tiene valores aceptables de precisión intermedia (11).
Especificidad: La especificidad implica mostrar que el método no se ve influenciado por impurezas o excipientes. Esto significa que debe poder identificar y medir el analito, sin importar las otras sustancias presentes en la muestra. Un requisito esencial de un análisis de separación es poder comprobar la pureza de las sustancias separadas, es decir, asegurar que no haya impurezas que se mezclen con el analito de interés. La confirmación de la pureza del pico debe realizarse antes de utilizar la información cuantitativa de un pico cromatográfico para cálculos posteriores (12). En la práctica, esto se puede hacer enriqueciendo la sustancia de fármaco o producto con niveles apropiados de impurezas o excipientes, demostrando que el resultado del ensayo no se ve afectado por la presencia de estos materiales extraños (6).
Al no contar con estándares de impurezas para llevar a cabo dicho procedimiento, se evaluó la especificidad mediante la comparación de los resultados obtenidos en pruebas con muestras sometidas a condiciones de estrés, a fin de estudiar la presencia de posibles sustancias degradadas que contuvieran posibles productos de degradación. Estas comparaciones incluyen muestras almacenadas durante siete días, en condiciones específicas de luz, calor, hidrólisis ácida, hidrólisis básica y oxidación (12).
El procedimiento realizado para la evaluación de la especificidad del método consistió en pesar aproximadamente 5 g de muestra en un matraz aforado de 10,0 mL; este procedimiento se realizó para cada una de las condiciones de manera independiente. Seguidamente, las muestras fueron sometidas a cada una de las siguientes condiciones de degradación forzada que se mencionan a continuación:
- Fotólisis: Se expuso a un sistema con exposición directa a la luz proveniente de una lámpara incandescente de 15 W/120 V/60 Hz, durante siete días.
- Hidrólisis ácida: Se añadió 1,00 mL de ácido clorhídrico (HCl) 0,1 N. Se dejó en reposo por 7 días.
- Hidrólisis básica: se añadió 1,00 mL de hidróxido de sodio (NaOH) 0,1 N. Se dejó en reposo por 7 días; durante este procedimiento se observó que la solución se tornó de color blanco.
- Oxidación: Se le añadió 1,00 mL de peróxido de hidrógeno (H2O2) al 3%. Se dejó en reposo por 7 días.
- Termólisis: Se sometió la muestra a calentamiento en un baño de agua durante 3 horas a una temperatura controlada de 60°C, procedimiento realizado el mismo día del análisis cromatográfico.
Culminado el periodo de exposición de cada una de las condiciones de estrés evaluadas, se procedió a realizar el análisis según la metodología cromatográfica propuesta.
La determinación de la pureza de pico cromatográfico pudo ser realizada gracias al detector de red de diodos (PDA); esta es una herramienta poderosa a la hora de verificar los espectros de los compuestos separados por cromatografía. Este análisis de pureza puede basarse en la comparación de los diversos espectros registrados durante la elución del pico. Si el pico cromatográfico es puro, la correlación entre el ángulo de pureza (PA) y el ángulo del umbral (TH) es menor. Si se encuentran desviaciones significativas, esto puede verse como una indicación de impureza.
Exactitud: La determinación de la exactitud se realizó según el método de agregado de estándar, el cual consiste en añadir a las muestras una cantidad conocida de patrón, para obtener tres niveles de concentración correspondientes a 70, 100 y 130% de la curva de calibración. Se realizaron nueve determinaciones (tres réplicas de las tres concentraciones). Para calcular el porcentaje de recuperación, se aplicó la (ecuación 5).
Porcentaje de recuperación = (Cfortificada − Csin fortificar) × 100 ⁄ CA
Donde Cfortificada representa la concentración de ambroxol y clembuterol en la muestra fortificada, Csin fortificar la de esas mismas sustancias en la muestra sin añadirle el estándar y CA es la concentración del ambroxol y clembuterol del estándar añadido.
Aplicación del método propuesto para la determinación simultánea de ambroxol y clembuterol en jarabe: Una vez validada la metodología analítica para la determinación simultánea del ambroxol y clembuterol, se procedió a analizar dos medicamentos, de la misma marca comercial, pero diferentes lotes y vigentes para el momento de la investigación. Una vez culminadas las pruebas, se llevaron a volumen empleando fase móvil. Las muestras fueron tratadas por separado, según la metodología propuesta, y se determinaron las cantidades de ambroxol y clembuterol CV (%) y porcentaje con respecto a lo declarado (ecuación 6).
Porcentaje de recuperación = C × 100 / Cdeclarada
Donde C encontrada se refiere a la cantidad de principio activo encontrado según el análisis y C declarada corresponde a la cantidad de principio activo declarada por el fabricante. La USP establece que los porcentajes con respecto a lo declarado deben encontrarse entre 90-110%. En general, la aceptación a priori de una variación de ±10% a partir de la cantidad declarada esperada (100%) en la mayoría de los casos pretende tomar en cuenta la variabilidad de la fabricación y la estabilidad durante la vida útil. Esto se debe a que tal variación tiene una menor probabilidad de ocasionar un impacto adverso perceptible en el resultado clínico deseado.
3. RESULTADOS Y DISCUSIÓN
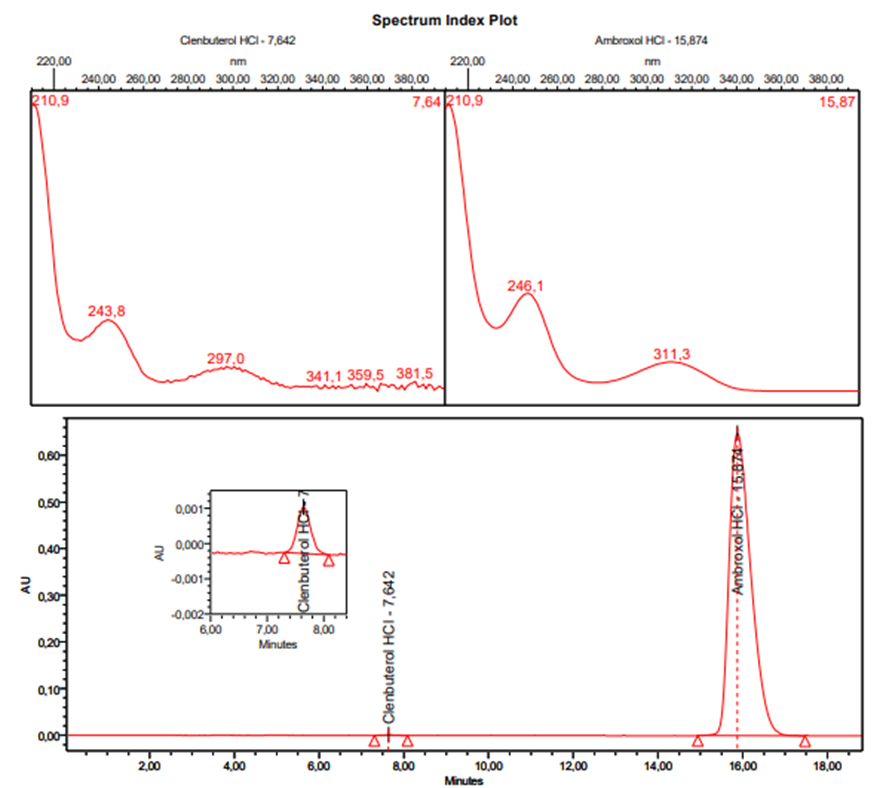
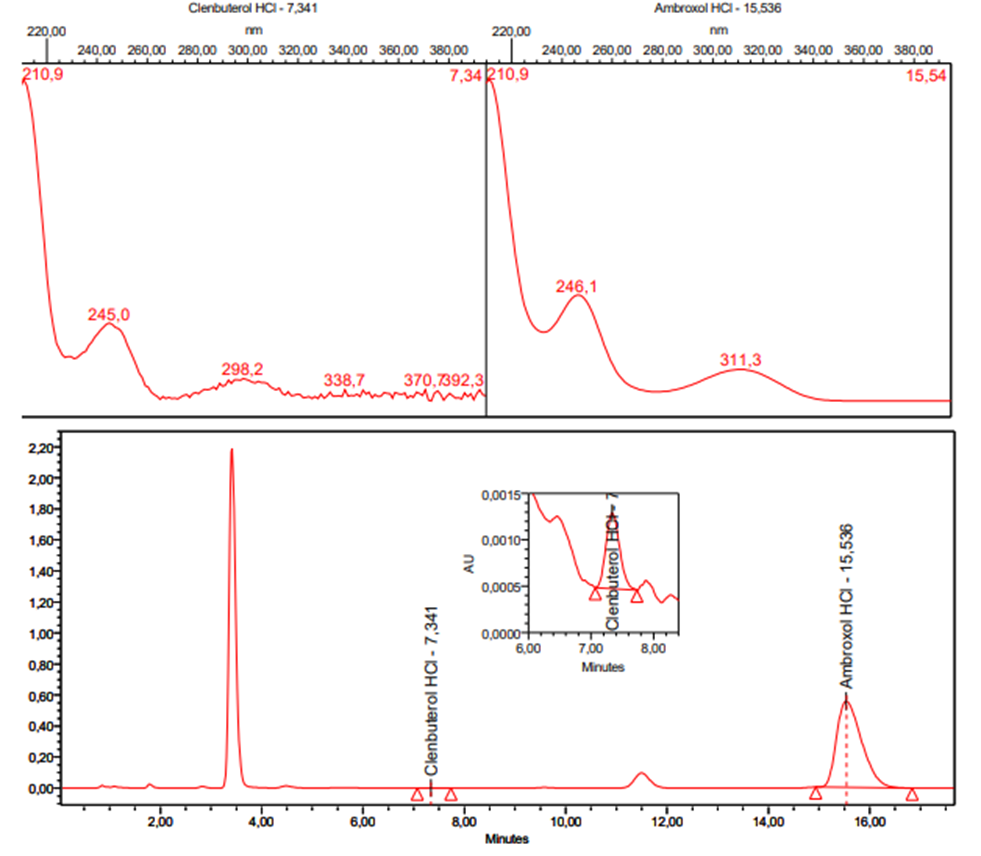
En la figura 3 y figura 4 se presentan los espectros de absorción UV y cromatogramas correspondientes al estándar combinado y muestra, respectivamente. Se pueden observar las señales cromatográficas correspondientes a ambroxol y clembuterol. En ambos cromatogramas se puede evidenciar que no existen interferencias.
Figura 3. Espectros UV y cromatograma de un estándar combinado de ambroxol y clembuterol
Figura 4. Espectros UV y cromatograma de una muestra de jarabe de ambroxol y clembuterol. Los picos en torno a 10 y 12 minutos se atribuyen a excipientes o vehículos que están presentes en la muestra.
Tabla 1. Concentraciones empleadas para las curvas de calibración
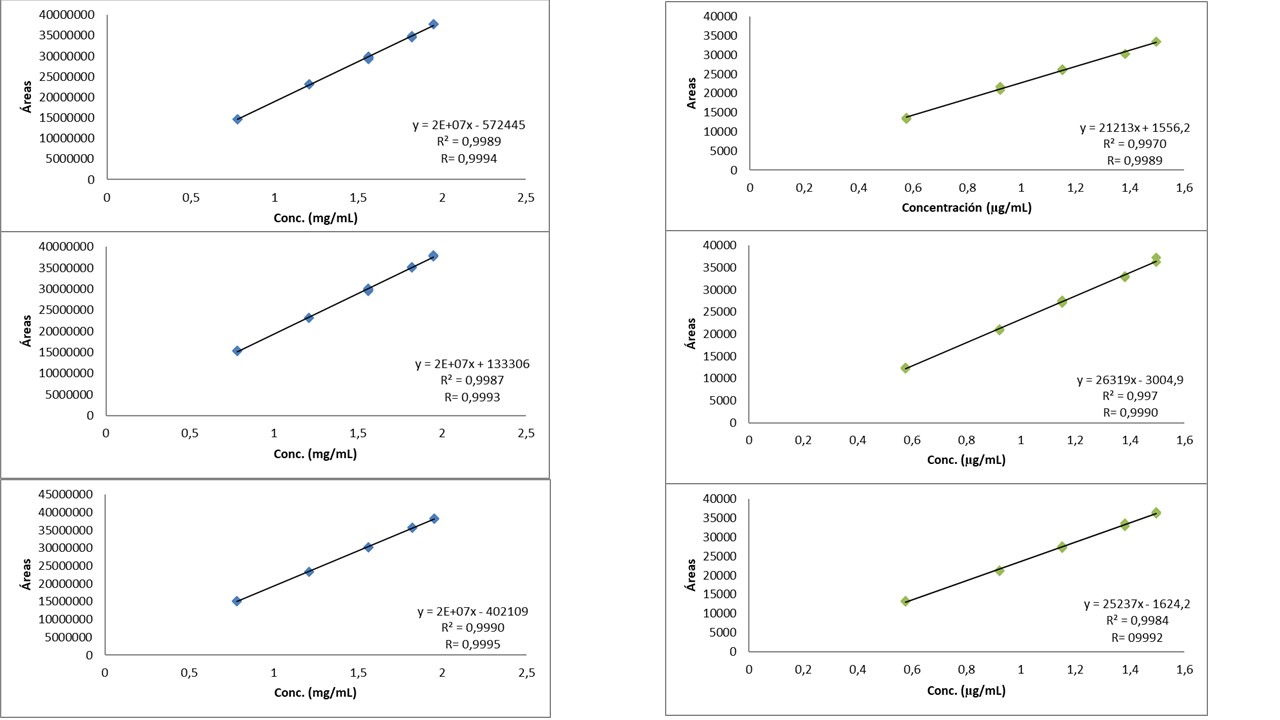
Linealidad: Se realizó una curva de calibración con cinco niveles de concentración, tabla 1. En la figura 5 se presentan las curvas de calibración para ambroxol y clembuterol, obtenidas en tres días diferentes. Estas curvas muestran el área total de las señales cromatográficas en relación con la concentración del estándar.
Figura 5. Curvas de calibración de ambroxol (izquierda) y clembuterol (derecha) realizadas en tres días diferentes.
Las curvas de calibración obtenidas demuestran que el método es lineal, ya que existe proporcionalidad entre las áreas y la concentración de ambos analitos en diferentes días de estudio, presentando valores de R ≥ 0,999 que cumplen con los criterios de aceptación establecidos en la USP e ICH. Adicionalmente, el coeficiente de determinación (R²) aporta una mayor significación estadística, por ser R² un parámetro de mejor ajuste (14).
La información obtenida con el cálculo de los coeficientes de correlación y determinación es limitada y no justifica por sí sola la linealidad; es por ello que es importante sustentar este resultado con pruebas que permitan evaluar la pendiente. Esto se realizó a través de la determinación del coeficiente de variación de los factores de respuesta, siendo el factor de respuesta (f) la relación entre la lectura o respuesta y la concentración, y puede tomarse como una expresión aproximada de la sensibilidad de calibración (área obtenida del patrón/concentración de analito), cuyo porcentaje del coeficiente de variación de los factores de respuesta % CVf no debe ser mayor del 5% (13). Estos coeficientes se calcularon para cada curva. En la tabla 2 se muestran los criterios de aceptación para el ambroxol y el clembuterol.
Tabla 2. Criterios de aceptación para la linealidad.
R=Coeficiente de correlación R²=Coeficiente de determinación % CVf = coeficientes de variación de los factores de respuesta.
La linealidad no se vio afectada por la variabilidad de las condiciones ambientales del estudio en diferentes días, ya que, en las curvas de calibración en los distintos días, tanto para el ambroxol como para el clembuterol, se obtuvo un %CVf menor al 5 %, indicando que existe una correlación lineal significativa entre las áreas obtenidas y la concentración de los analitos.
Precisión: El estudio de la precisión del método se realizó a través de la evaluación de la precisión del sistema cromatográfico, la repetibilidad y la precisión intermedia.
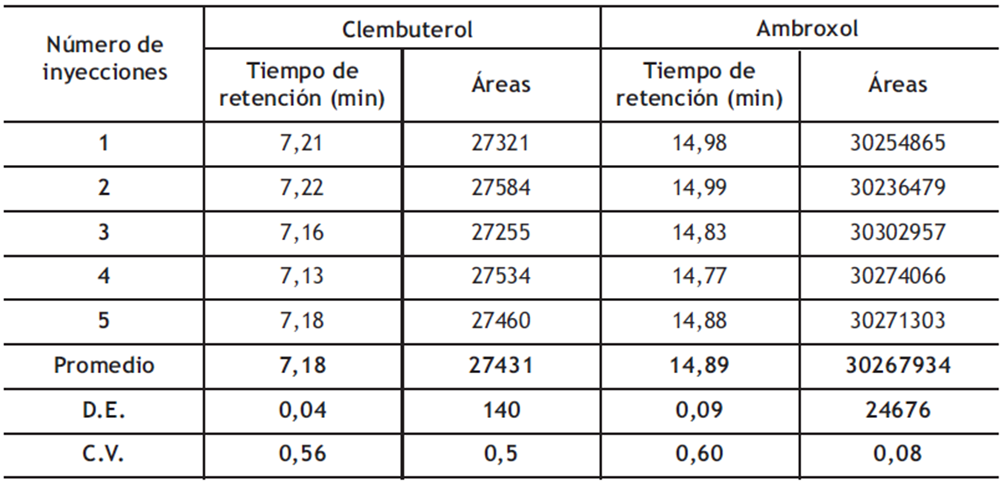
Precisión del sistema cromatográfico: La precisión del sistema cromatográfico se evaluó analizando la variación de los valores obtenidos en el tiempo de retención y el área de los dos analitos. En la tabla 3 se muestra el número de inyecciones realizadas del patrón combinado que contenía 1,56 mg/mL de ambroxol y 1,152 µg/mL de clembuterol. Los valores de coeficiente de variación, tanto para el tiempo de retención como para el área, son inferiores al 2%, lo cual demuestra que el método cumple con los criterios establecidos en la USP para la precisión del sistema.
Tabla 3. Precisión del sistema cromatográfico.
D.E. = desviación estándar C.V. = coeficiente de variación
Repetibilidad: Los resultados obtenidos para la repetibilidad del método analítico se muestran en la tabla 4. A partir de las áreas obtenidas con estas muestras y una curva de calibración preparada ese día, se determinó el valor promedio y el coeficiente de variación de la cantidad de ambroxol y clembuterol en el jarabe (mg/mL). Los resultados muestran la repetibilidad del método analítico, ya que el valor del coeficiente de variación fue menor a 2%.
Tabla 4. Repetibilidad del método.
D.E. = desviación estándar C.V. = coeficiente de variación
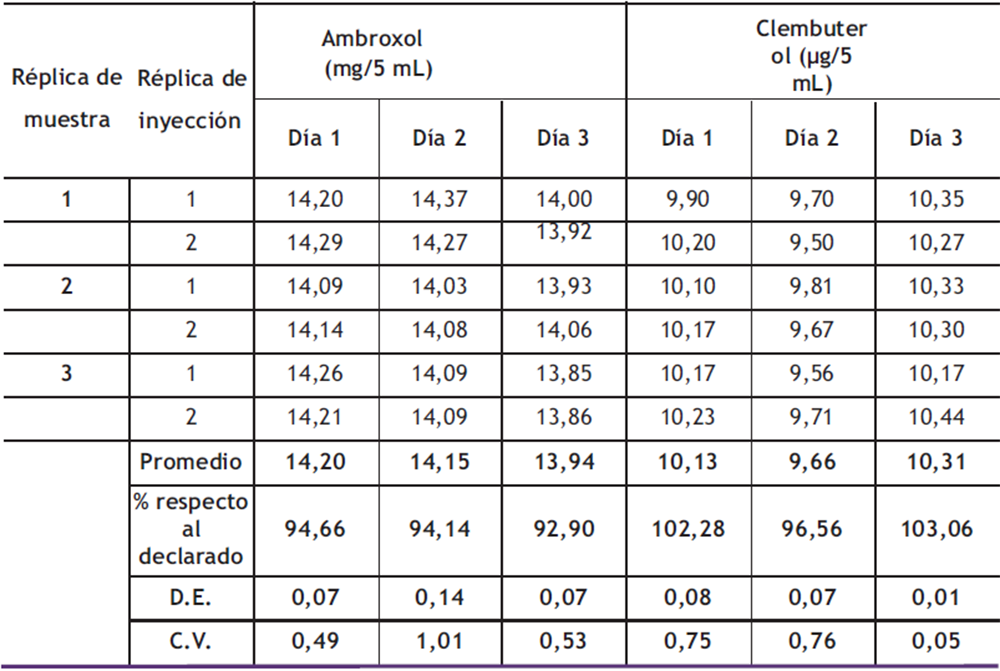
Precisión intermedia: Los resultados para evaluar la precisión intermedia del método analítico propuesto se muestran en la tabla 5. Se puede observar que en los diferentes días de análisis se obtienen distintos valores de concentración, tanto para el clembuterol como para el ambroxol, pero se evidencia una concentración porcentual en base a lo declarado (cada 5 mL de jarabe contenía 10 µg de clembuterol y 15 mg de ambroxol, en 120 mL de jarabe) de 94,66%; 94,14%; 92,90% para los días 1, 2, 3, en el ambroxol, y para el clembuterol se obtuvo 102,28%; 96,56%; 103,06% para los días 1, 2, 3, respectivamente. Estos porcentajes se encuentran dentro del criterio de aceptación de 90–110 %; por lo tanto, el método es aceptable. Los coeficientes de variación son menores al 2 % para ambos analitos y en diferentes días. Esto muestra que la precisión, medida a través de la precisión intermedia, está dentro de los límites permitidos para los métodos cromatográficos.
Tabla 5. Precisión intermedia.
Para comparar la tolerancia correspondiente a la precisión intermedia, se puede usar la conocida como Trompeta de Horwitz (14). El coeficiente de variación obtenido en el análisis es comparado con el de Horwitz. Se obtuvo un promedio para el clembuterol de 10,03 mg/mL y un coeficiente de variación de 3,37%; y para el ambroxol, un promedio de 14,10 mg/mL y un coeficiente de variación de 1,00%. Para ambroxol, un CVH =1,63 y para clembuterol, un CVH = 1,42. Por lo tanto, el método tiene valores aceptables de precisión intermedia, ya que el valor obtenido en el parámetro CVH para ambos analitos es menor a CV del análisis, demostrando así que el método es preciso (15).
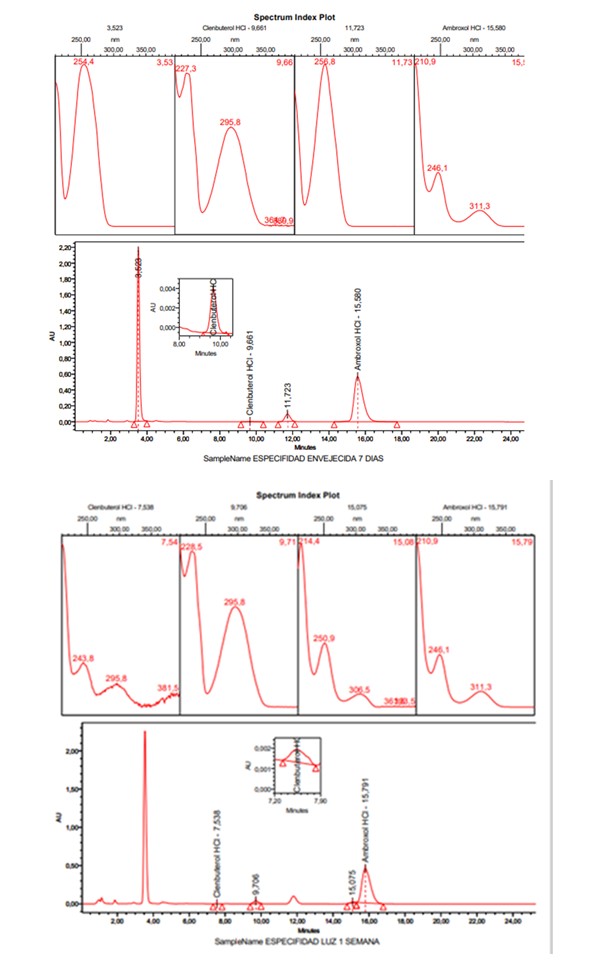
Especificidad: Los cromatogramas y gráficos de pureza cromatográfica obtenidos para los estudios de especificidad del método se presentan en la figura 6.
Figura 6. Cromatogramas y espectros UV de muestras sometidas a condiciones de estrés: (a) muestra almacenada siete días después de su preparación, (b) fotólisis, (c) estrés oxidativo, (d) hidrólisis ácida, (e) hidrólisis básica, (f) termólisis. Los gráficos corregidos se presentan en un documento aparte.
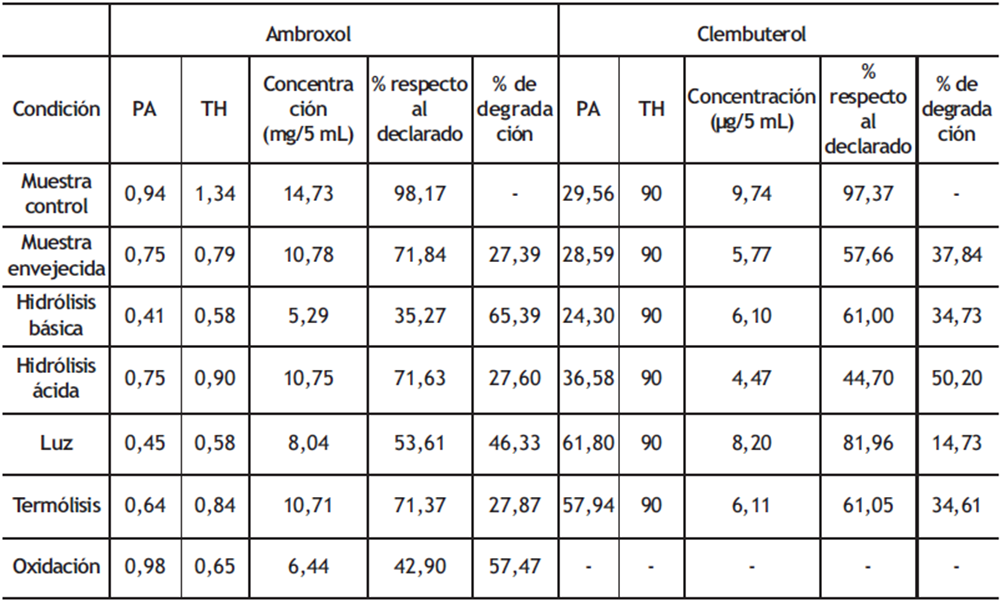
Los resultados de las pruebas de degradación bajo estrés, que se realizaron para evaluar la especificidad del método, también se usaron para determinar el porcentaje de degradación que tuvieron las disoluciones de las muestras en las diferentes condiciones de análisis. Estos resultados proporcionan información sobre el grado de degradación que se da lugar en la muestra bajo condiciones de fotólisis, termólisis, oxidación, hidrólisis ácida e hidrólisis básica. En la tabla 6 se presentan los valores obtenidos de ángulo de pureza y umbral de ruido, así como porcentajes de degradación; se observa una degradación mayor al 20 % con respecto a la concentración inicial de los fármacos, que es lo recomendado por la AEFI para estudiar la estabilidad de las muestras (13).
Tabla 6. Resultados del estudio de especificidad del método
PA=ángulo de pureza; TH=umbral de ruido.
Este tipo de estudios adquiere especial importancia para los métodos que serán aplicados en la evaluación de la estabilidad de un principio activo o forma farmacéutica. Se debe comprobar, a ser posible, la identidad del analito y que la señal proviene solo de él (13).
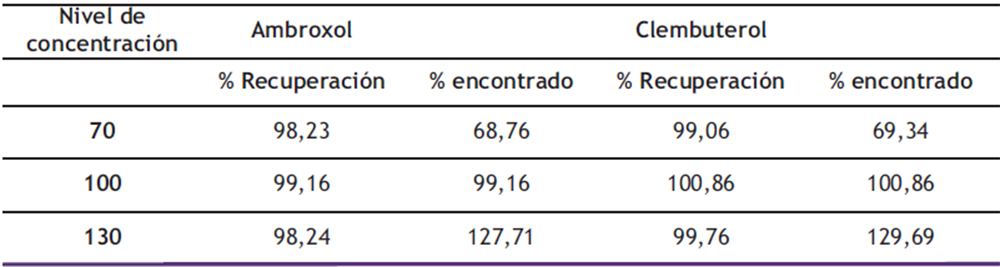
Exactitud: Los resultados del estudio de la exactitud son presentados en la tabla 7. Se puede observar que la metodología es exacta, ya que los porcentajes de recuperación obtenidos se encuentran dentro del rango establecido para cada uno de los niveles (70%, 100% y 130%). Para que un método analítico sea considerado exacto, el promedio del porcentaje recuperado debe estar entre 98% y 102%, y la desviación estándar relativa debe ser 2,5% (18) o menor. En función de estos resultados, se confirma que el método analítico es exacto.
Tabla 7. Exactitud
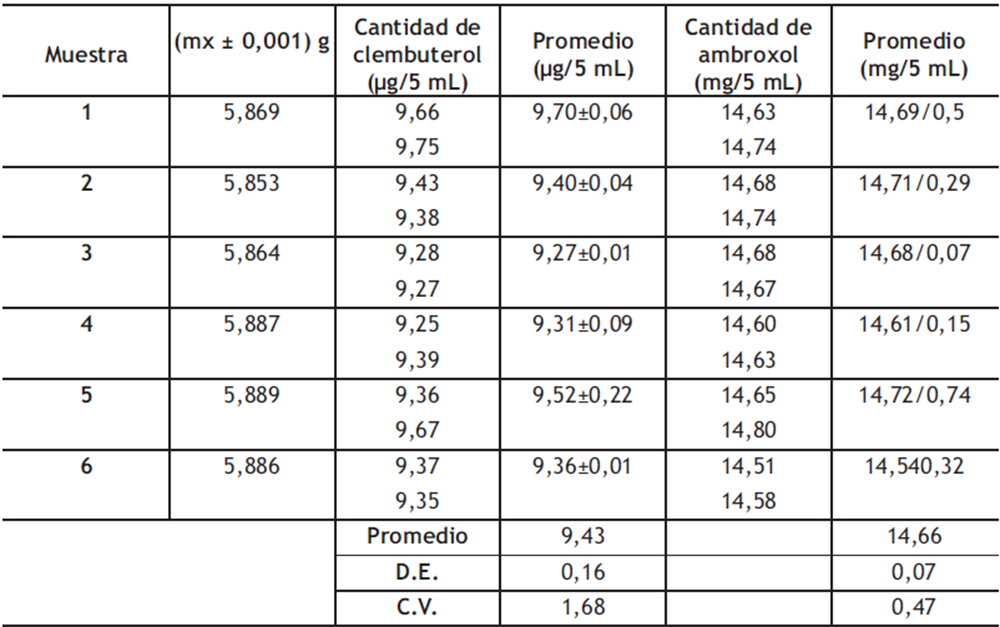
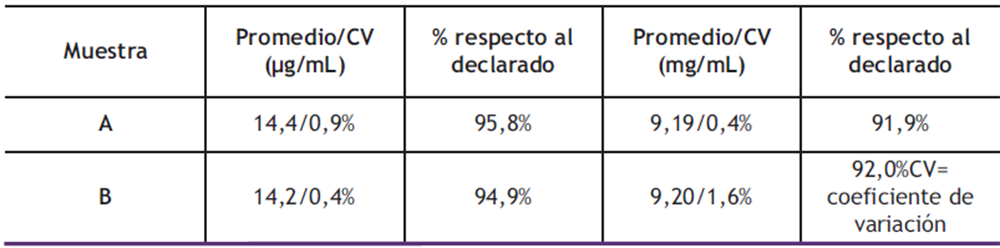
Análisis de jarabes de ambroxol y clembuterol: Una vez validada la metodología analítica para la determinación simultánea del ambroxol y clembuterol, se procedió a analizar dos medicamentos, de la misma marca comercial, pero de diferentes lotes. Los resultados obtenidos se presentan en la tabla 8. Se puede apreciar que el método es capaz de cuantificar ambroxol y clembuterol de manera simultánea, con precisión y exactitud, ya que en todos los casos los resultados cumplen satisfactoriamente con los criterios establecidos en la USP, es decir, coeficientes de variación menores a 2% y porcentajes con el declarado entre un (90-110) %.
Tabla 8. Determinación del contenido de ambroxol en diferentes muestras de jarabe
4. CONCLUSIONES
El método analítico validado para la determinación simultánea de ambroxol y clembuterol presentó una serie de ventajas con respecto a lo reportado en la literatura, siendo una de las más importantes el hecho de poder analizar de manera simultánea el ambroxol y el clembuterol en un jarabe; a pesar de la baja concentración de este último, se encontró que el método posee un excelente límite de detección y cuantificación que así lo permite. También es importante señalar que la metodología propuesta utiliza la HPLC con DAD, lo cual resulta sumamente ventajoso en laboratorios farmacéuticos que cuenten con este instrumento. Se estableció que la evaluación de la linealidad en diferentes días demostró que existe una correlación lineal significativa, sin variación entre días, ya que los coeficientes de variación de los factores de respuesta fueron menores al 5%, lo cual permite comprobar la poca variabilidad en la sensibilidad del método, tanto para ambroxol como para clembuterol. El método cromatográfico desarrollado es preciso, al presentar coeficientes de variación menores al 2% para la precisión del sistema cromatográfico (tanto en los tiempos de retención como en las áreas) y repetibilidad. Al evaluar la repetibilidad y la precisión intermedia, se encontró que el coeficiente de variación de Horwitz es CV del análisis, demostrando que el método es preciso para la cuantificación de ambos principios activos.
El método es específico, al permitir reconocer inequívocamente la presencia de ambroxol y clembuterol, discriminando la presencia de sustancias contaminantes.
La exactitud medida como porcentaje de recuperación para el ambroxol se encontró entre 68,76% y 127,71% y para el clembuterol entre 69,34% y 129,69% para niveles de concentración fortificados entre el 70% y 130%, resultados que se encuentran dentro de los límites del criterio de aceptación comprendido entre 98,0% y 102,0% para cada nivel, según lo establecido en la ICH.
El método que se ha creado y validado se puede usar en análisis regulares y control de calidad para medir clembuterol y ambroxol en jarabes, ya que ofrece resultados confiables y cumple con las normas de validación.
Agradecimiento
Los autores agradecen el apoyo prestado por parte de los miembros del Laboratorio de Análisis de Medicamentos, Facultad de Farmacia de la Universidad Central de Venezuela, y a la Fundación María Paula Alonso de Ruiz Martínez.
5. REFERENCIAS
- Malerba, M., Ragnoli, B. (2008) Ambroxol in the 21st century: pharmacological and clinical update. Expert Opin Drug Metab Toxicol 4, 1119–1129.
- Rogers, D. F. (2007). Mucoactive agents for airway mucus hypersecretory diseases. Respir Care 52, 1176–1197.
- Al-Majed, A. A., Khalil, N. Y., Khbrani, I., Abdel-Aziz, H. A. (2017) Chapter Two – Clembuterol Hydrochloride, in Profiles of Drug Substances, Excipients and Related Methodology (Brittain, H. G., Ed.), pp 91–123. Academic Press.
- Al-Majed, A. A., Khalil, N. Y., Khbrani, I., Abdel-Aziz, H. A. (2017) Chapter Two – Clembuterol Hydrochloride, in Profiles of Drug Substances, Excipients and Related Methodology (Brittain, H. G., Ed.), pp 91–123. Academic Press.
- Rampazzo, P. (1990) Standardisation and validation of analytical methods in the pharmaceutical industry. Fármaco 45, 807–815.
- Farmacopea de los Estados Unidos de América (2019) USP 42 NF 37.
- ICH Harmonised Tripartite Guideline. (2005). Validation of analytical procedures: Text and methodology (Q2(R1)). International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use.
- Lin N, Chen XY, Song B, Zhong DF. [Determination of ambroxol and clembuterol in human plasma by LC-MS/MS method]. Yao xue xue bao = Acta Pharmaceutica Sinica. 2007 Mar;42(3):308-313. PMID: 17520832.
- Acosta Neira, M. A., & Nina Flores, S. D. R. (2014). Validación de una técnica analítica por cromatografía líquida de alta performance (HPLC) y cálculo de la incertidumbre para los ensayos de ambroxol clorhidrato y clembuterol clorhidrato en un jarabe, Arequipa–2013.
- Morales Coronado, E. S. (2017). Desarrollo de un método para la cuantificación de clembuterol y ambroxol en jarabes para la tos por medio de cromatografía líquida de alta resolución (Tesis de pregrado). Universidad Nacional Autónoma de Honduras, Tegucigalpa, Honduras.
- Horwitz, W., Albert, R. (2006) The Horwitz ratio (HorRat): a useful index of method performance with respect to precision. J AOAC Int 89, 1095–1109.
- Shah, B. P., Jain, S., Prajapati, K. K., Mansuri, N. Y. (2012) Stability indicating HPLC method development: A Review. Int J Pharm Sci Res 3, 2978.
- Asociación Española de Farmacéuticos en la Industria (AEFI). (2001) Validación de métodos analíticos. Barcelona.
- López-Roldán, P., Fachelli, S. (2016) Análisis de regresión. Metodología de la investigación social cuantitativa.
- Duffau, B., Rojas, F., Guerrero, I., Roa, L., Rodríguez, L., Soto, M., Aguilera, M., Sandoval, S. (2010) Validación de métodos y determinación de la incertidumbre de la medición: “Aspectos generales sobre la validación de métodos”.
- Parra, Z., Bor, M., Gómez, L. (2017) Desarrollo y validación de un método analítico por RP-HPLC para la determinación simultánea de clorhidrato de ambroxol y loratadina en jarabes. Revista de la Facultad de Farmacia 80, 102–118.
- Albert, R., Horwitz, W. (1997) A heuristic derivation of the Horwitz curve. Anal Chem 69, 789–790.
- Lister, A. S. (2005) Validation of HPLC methods. Handbook of Pharmaceutical Analysis by HPLC 6, 191.