1. INTRODUCCIÓN
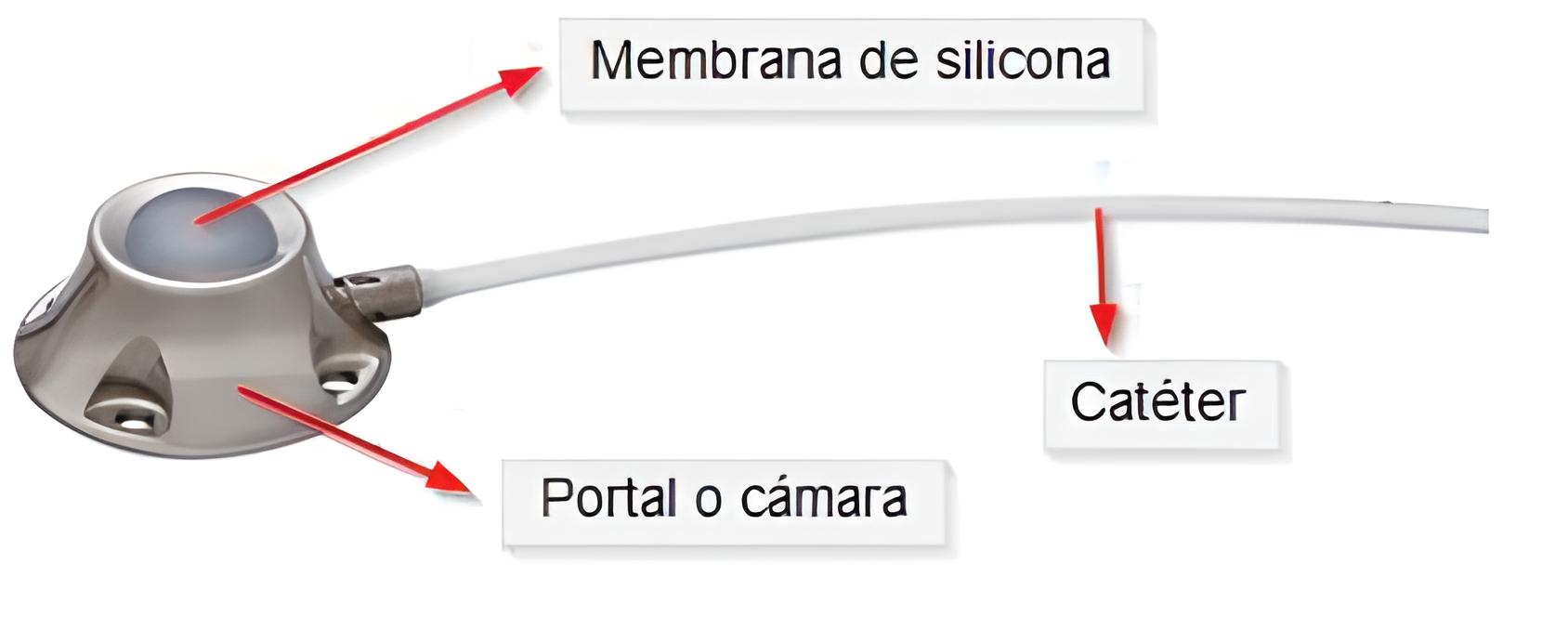
El reservorio venoso subcutáneo (RVS) es un dispositivo implantable para acceso venoso permanente y de larga duración (Figura 1) y, por tanto, es un tipo de catéter venoso central (CVC). La aplicación de un catéter venoso central (CVC) es frecuente en pacientes que requieren tratamiento intravenoso de larga duración, principalmente en pacientes oncológicos, y es especialmente útil en enfermos con accesos venosos difíciles, en enfermos con sida. El empleo de reservorios venosos subcutáneos se ha extendido debido, fundamentalmente, a sus numerosas ventajas: facilidad de implantación sin requerir ingreso, pocas molestias en su colocación y uso, que puede ser ambulatorio (1-3).
Figura 1. Reservorio venoso subcutáneo (Imagen del documento: Recomendaciones al paciente: autocuidados del reservorio venoso subcutáneo. Hospital Universitario Severo Ochoa de Madrid. https://www.comunidad.madrid/hospital/severoochoa/file/2921/download?token=CuIomIiU)
2. INFECCIÓN RELACIONADA CON EL CATÉTER
Uno de los problemas detectados en el empleo de estos sistemas se centra en la posible infección del catéter. Aunque existen varios tipos de infecciones asociadas a catéter (IAC), la presente revisión se centra exclusivamente a las bacteriemias (Catheter-Related Blood-Stream Infections, CRBSI). La fuente principal que causa las bacteriemias hospitalarias es el uso de los catéteres venosos centrales (4-5). Así, la contaminación de los catéteres se ha asociado con un 25% de mortalidad, y/o con una prolongación del tiempo de hospitalización de los pacientes (6). A pesar de los avances, las infecciones asociadas a catéter venoso central (CVC) siguen constituyendo una de las complicaciones más importantes (7-8). El riesgo de complicaciones incrementa proporcionalmente con el tiempo de uso del dispositivo (9-10).
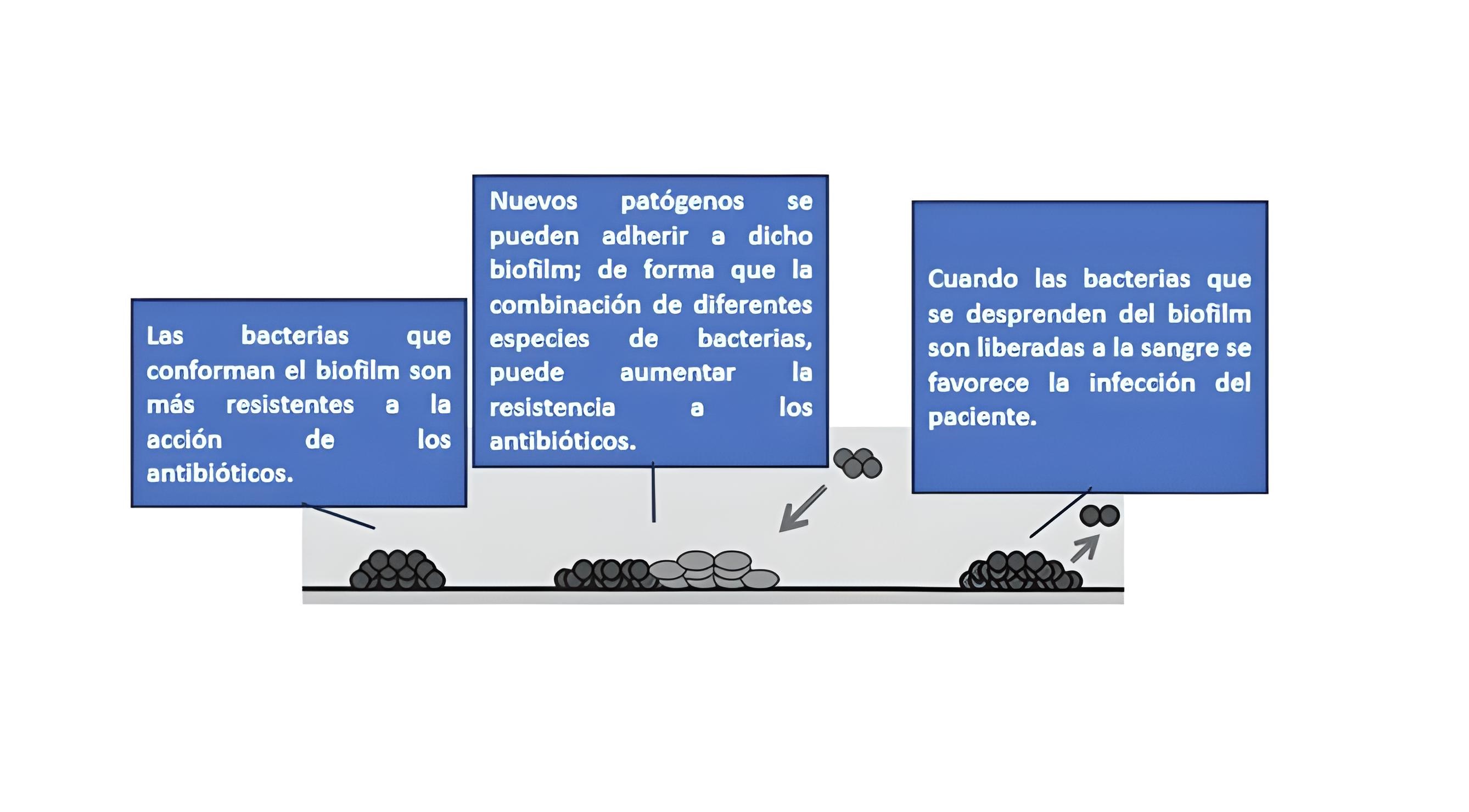
Se ha observado que la utilización prolongada del catéter manifiesta la formación de un biofilm bacteriano en la superficie del reservorio, que conlleva a la sustitución del catéter, ocasionando malestar en el paciente. Pero el mayor problema es que no en todos los casos es factible realizar el recambio del catéter, ya sea porque el paciente ha sido sometido a diversos procedimientos y/o por su condición fisiopatológica (11-16). El recambio del reservorio subcutáneo está condicionado por los mecanismos de resistencia de los gérmenes que conforman el biofilm y que contribuyen a desarrollar la infección en el paciente, como se resume en la Figura 2 (16). Se han descrito casos de pacientes que, además, tienen una susceptibilidad individual a desarrollar infecciones asociadas a catéter (IAC) de repetición, sin que exista una razón aparente que lo justifique (16). En consecuencia, la retirada del reservorio se considera como último recurso (16-17).
Figura 2. Mecanismos de resistencia de los gérmenes que conforman el biofilm (Figura modificada de referencia 16).
2.1. Sellado antibiótico de los catéteres
Se han desarrollado diferentes opciones encaminadas a prevenir la contaminación de los catéteres, siendo una de estas, la que utiliza antibióticos, denominada como “sellado antibiótico de catéteres” o SAC (18-19).
El sellado antibiótico de catéteres (SAC) se ha relacionado con una reducción de la necesidad de retirar el catéter en infecciones relacionadas con éstos, salvo cuando el germen responsable de la infección sea Staphylococcus aureus o Candida que la recomendación es retirar el catéter.
Dado que las bacterias que conforman el biofilm son 100-1.000 veces más resistentes a la acción de los antibióticos que las bacterias circulantes, la erradicación de dichas infecciones precisan del uso de concentraciones supraterapéuticas de antibiótico que permanezcan en contacto con el reservorio durante horas-días, en forma de sellados (11-14, 16-22).
Existe una gran diversidad de agentes con propiedades antiinfecciosas que se están utilizando en el sellado antibiótico de catéteres: para el tratamiento de IAC por estafilococos meticilin-sensibles se recurre a cefazolina y para los meticilin-resistentes se recurre a vancomicina; para el tratamiento de IAC por Gram negativos, se pueden emplear sellados de ceftazidima, gentamicina o ciprofloxacino; para el tratamiento de especies de enterococo que sean sensibles a ampicilina el agente de elección es la ampicilina, reservándose la vancomicina para enterococos resistentes a ampicilina (16, 23-26).
2.2. Soluciones para Sellado Antibiótico de Catéteres con Vancomicina
Uno de los desafíos de las soluciones para SAC son los biofilms generados por los microorganismos, cuya estructura tridimensional confiere protección frente a la acción de los antibióticos. Existe una gran variedad de microorganismos con capacidad para formar biofilms, pudiendo ser bacterias Gram negativas, Gram positivas o levaduras. Entre las bacterias que forman biofilm, están los estafilococos, en concreto, Staphylococcus epidermidis, siendo la especie más común responsable de la infección de catéteres (27-28). Se ha observado que vancomicina es el antimicrobiano de elección frente a estafilococos meticilin-resistentes (16), estableciéndose que la concentración de vancomicina más eficaz para erradicar el estafilococo del biofilm es 5mg/mL (29). De hecho, se ha descrito que la mejor alternativa para el SAC frente a microorganismos Gram positivos, incluidos los estafilococos resistentes a meticilina es vancomicina (2–10 mg/mL) (30).
Por esta razón, la presente revisión se centra en las soluciones para sellado de catéteres tipo reservorio subcutáneo con vancomicina.
Cuando se usan catéteres venosos centrales (CVC) como los reservorios subcutáneos, el personal sanitario necesita evitar 2 grandes riesgos: formación de coágulos e infecciones bacterianas.
El compuesto anticoagulante más empleado en el sellado antibiótico de catéteres es la heparina. El sellado de los catéteres con heparina disminuye las oclusiones del catéter con elevada eficacia en pacientes con catéteres venosos centrales (CVC) (31-32).
También se han empleado agentes quelantes como el ácido etilen diamin tetra acético (EDTA) y el citrato trisódico (TSC) en soluciones de sellado, basándose en que cationes metálicos juegan un papel importante en el crecimiento de las bacterias (16, 33). Un panel de expertos para dispositivos de acceso venoso desarrolló un consenso sobre los criterios basados en la evidencia para la elección y el uso clínico de la solución de sellado más adecuada para los CVC (excluyendo los catéteres de diálisis) y, entre sus conclusiones, recoge que la solución de sellado más adecuada debe incluir citrato ya que tiene actividad tanto antibacteriana como antibiofilm (34-40).
2.3. Estabilidad de soluciones de sellado antibiótico de catéteres con vancomicina
Aunque se han obtenido resultados satisfactorios con la utilización de la técnica de sellado antibiótico de los catéteres, de igual forma se han encontrado resultados negativos, que bien pudieran relacionarse con la incapacidad de difundir y penetrar en el biofilm bacteriano, con la necesidad de utilizar concentraciones muy elevadas de antibiótico para alcanzar concentraciones eficaces, el tiempo que debe permanecer este en la luz del catéter y la combinación apropiada de anticoagulante o antibiofilm, entre otras (12,18,23). Los dos últimos aspectos pueden relacionarse con la estabilidad de las soluciones antimicrobianas utilizadas, que deben permanecer eficaces durante el tiempo de permanencia en el reservorio, y con la compatibilidad del antimicrobiano con los adyuvantes como heparina y citrato sódico.
La estabilidad de las soluciones de sellado antibiótico con agentes antimicrobianos se basa en parámetros que, entre otros, consideran (30,41): mantener el aspecto de una solución límpida con ausencia de precipitados, partículas, gas, cambios de color o cambios de viscosidad u otras alteraciones aparentes, así como mantener una concentración del agente antimicrobiano superior o igual al 90% del valor inicial.
El presente trabajo se centra en realizar una revisión bibliográfica de los estudios de estabilidad de las soluciones con vancomicina combinada con heparina o combinada con citrato, utilizadas en la técnica de sellado antibiótico de catéteres.
2.3.1. Estabilidad física: compatibilidad de soluciones de vancomicina con heparina o con citrato
Diversos estudios han permitido demostrar que las soluciones de sellado antibiótico con vancomicina poseen compatibilidad física con heparina cuando se emplean concentraciones de vancomicina por debajo de los 0,5mg/mL y de heparina sódica con valores por debajo de las 100UI/mL, así como, cuando se utilizan concentraciones de vancomicina entre los 0,1mg/mL y los 10mg/mL, en combinación con 100UI/mL a 5.000UI/mL de heparina sódica (42-48). Sin embargo, se ha observado que al utilizar concentraciones de vancomicina por encima de los 5mg/mL en combinación con heparina sódica por encima de las 5.000UI/mL, la solución antibiótica de sellado no es límpida. Así, se ha descrito la aparición de un precipitado cuando se mezclan 10 mg/mL de vancomicina con 10.000 UI/mL de heparina; sin embargo, se ha visto que agitando la solución durante 10 segundos la precipitación se resuelve (16, 30, 49-53). Aun así, el protocolo de preparación de vancomicina y heparina para sellado de catéter de diversos Hospitales indica que la solución es de uso inmediato por riesgo de precipitación (54-55).
La vancomicina ha demostrado compatibilidad física en combinación con citrato en las soluciones de sellado de catéteres estudiadas: soluciones de vancomicina, a concentraciones entre 1mg/mL y 10mg/mL, con 20mg/mL y 40mg/mL de citrato, demostraron ser físicamente compatibles (37-38).
2.3.2. Estabilidad química: cuantificación por HPLC de vancomicina en soluciones de sellado
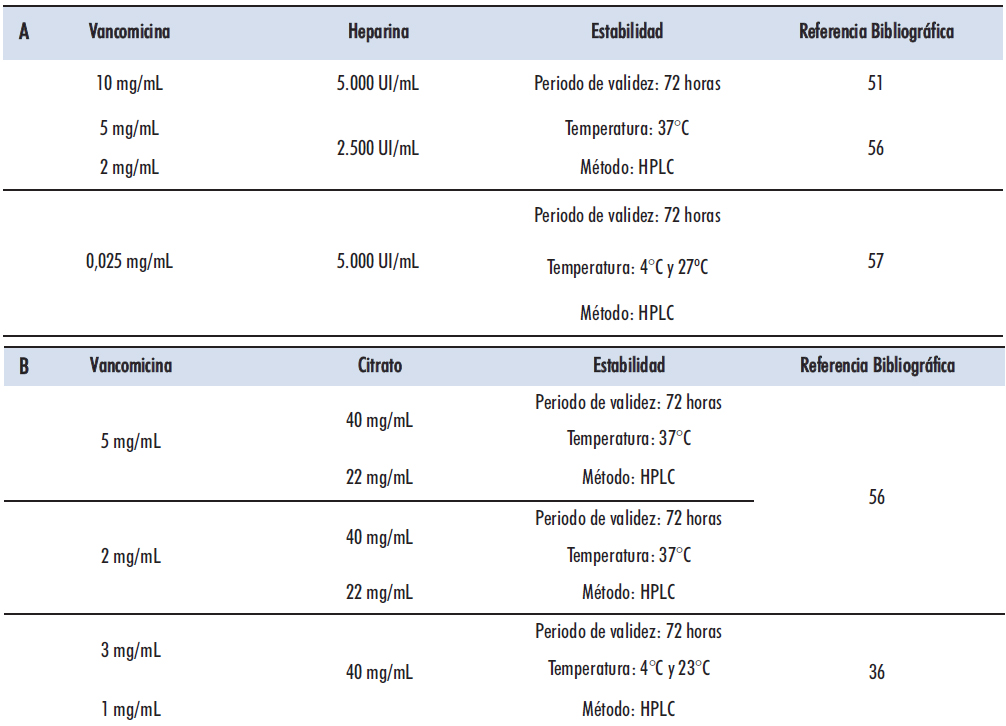
Los resultados obtenidos de la revisión de trabajos que recogen el análisis de las soluciones de vancomicina con heparina a distintas concentraciones se muestran en la Tabla 1.A, mientras que los resultados obtenidos del análisis de las soluciones de vancomicina con citrato a diferentes concentraciones se muestran en la Tabla 1.B. El periodo de validez se centra en el mantenimiento de una concentración del agente antimicrobiano superior o igual al 90% del valor inicial. En todos los estudios revisados, la duración de la solución se estableció en 72 horas.
Tabla 1. Estabilidad química de soluciones de sellado con Vancomicina: A. soluciones con vancomicina y Heparina. B. soluciones con vancomicina y citrato. (Fuente: elaboración propia)
2.3.3. Estabilidad físico-química: determinación de los valores de pH de las soluciones de SAC (58).
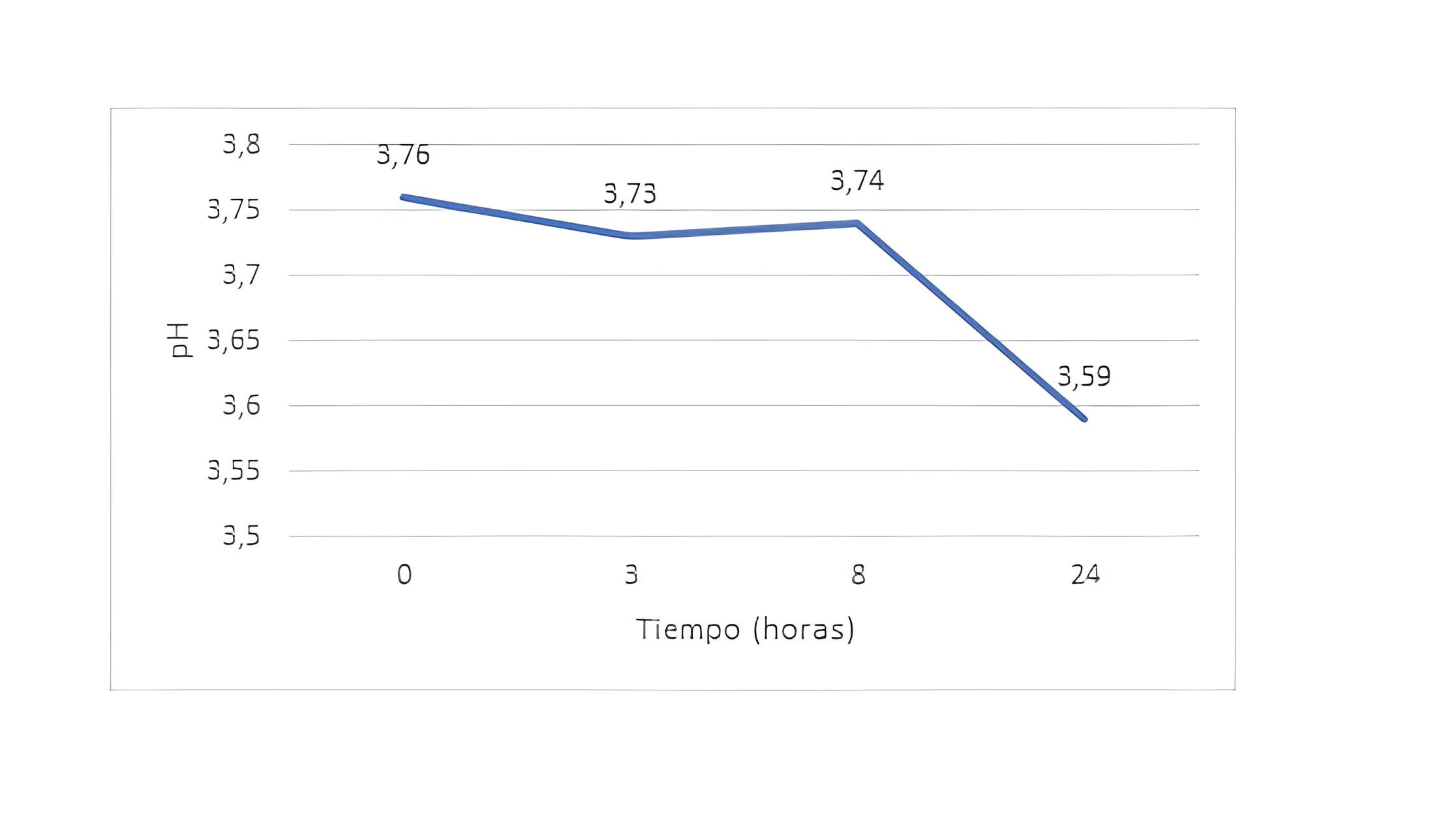
Barros (58) diseñó un estudio de estabilidad de una solución de vancomicina (5 mg/mL) sola o con heparina a 22º C y a 37º C y valoró la evolución de los valores de pH, tomando cuatro tiempos de muestreo: tiempo inicial, a las 3 horas, a las 8 horas y a las 24 horas. En los resultados se observó que no había cambios significativos en los valores de pH a lo largo de la duración del estudio (24 horas) para las condiciones de almacenamiento estudiadas y que estos valores de pH no diferían entre las distintas soluciones de vancomicina evaluadas (Figura 3).
Figura 3. Estabilidad del valor de pH de la solución de SAC con Vancomicina (Fuente: elaboración propia)
3. EFICACIA MICROBIOLÓGICA DE LAS SOLUCIONES DE SELLADO DE VANCOMICINA SOLA Y DE VANCOMICINA CON HEPARINA O CITRATO SÓDICO
Dada la importación de los estafilococos en la formación de biofilms en los reservorios subcutáneos, se recoge el trabajo de Luther (59) que aborda la evaluación de la actividad que ejercen soluciones de vancomicina (5mg/mL) sola y con heparina en la inhibición del crecimiento de estafilococos. Los resultados permitieron observar que no hubo una diferencia significativa en la inhibición del crecimiento microbiano por parte de las dos soluciones (vancomicina sola o con heparina). Aunque se observó un comportamiento similar, para el caso concreto de S. epidermidis, la solución de vancomicina con heparina superó el poder de inhibición de la solución de vancomicina sola, con un valor de 0,78 logUFC/mL, y para S. aureus, la solución de vancomicina sola fue la que mostró un mayor poder de inhibición de crecimiento microbiano, con un valor de 0,05logUFC/mL.
En el estudio in vitro realizado por LaPlante y Mermel (60), la solución de vancomicina (5 mg/mL) con heparina no solo pudo inhibir el crecimiento de S. epidermidis, sino que, además, consiguió evitar la formación del biofilm de dicho microorganismo; no obstante, no se obtuvo el mismo resultado en el caso de evitar la formación de biofilm por S. aureus.
El sellado de los catéteres también contempla en empleo de una solución de citrato sódico a una concentración igual o inferior al 4%, ya que este compuesto tiene propiedades antimicrobianas y actúa como agente quelante, dado que cationes metálicos como el Fe3+, el Mg2+ y el Ca2+ favorecen el crecimiento de las bacterias.
Se ha indicado que el empleo de citrato sódico en soluciones de sellado de catéteres confiere mayores beneficios en comparación con la heparina, debido, entre otros aspectos, a que no provoca hemorragia y/o trombocitopenia (61).
La revisión de estudios que comparan la actividad antimicrobiana de soluciones con citrato o con heparina en el sellado de catéteres evidencia que las soluciones con citrato parecen ser más efectivas contra las bacteriemias de los catéteres ya que presentan una incidencia significativamente menor de infecciones de catéter que cuando se emplean soluciones con heparina en las mismas condiciones, ofreciendo valores que suponen una reducción de un 65% de aparición de bacteriemias y una reducción de un 61% de los casos de retirada del dispositivo de forma prematura en cateterismos de larga duración (igual o superior a 1 año) (62-69).
4. CONCLUSIÓN
Las bacterias formadoras de biofilms son un grave problema de salud, agravado por la aparición de resistencia a los antibióticos. En un gran porcentaje, las infecciones nosocomiales están asociadas a la formación de biofilms bacterianos en el catéter.
En este sentido, el sellado antibiótico de catéteres es un tratamiento con un alto potencial para evitar infecciones y alargar la vida del catéter en aquellos pacientes que lo necesitan.
Desde el punto de vista galénico, se han abordado aspectos como la estabilidad de las soluciones de sellado antibiótico de catéteres y la compatibilidad entre los componentes de dichas soluciones (antibiótico, anticoagulante, quelantes, entre otros).
Los resultados observados en los estudios de estabilidad química revisados en presente trabajo indican que las soluciones con concentraciones de vancomicina en el intervalo 2mg/mL-10mg/mL y con heparina en concentraciones que van desde las 2.500UI/mL hasta las 5.000UI/mL, el periodo de validez es de 72 h a una temperatura de 37ºC (temperatura de uso del catéter subcutáneo).
Así, desde el punto de vista de la estabilidad química, habría que renovar la solución de sellado cada 72 horas como plazo máximo.
Los estudios de estabilidad química revisados para soluciones con concentraciones de vancomicina en el intervalo 1mg/mL-5mg/mL de vancomicina y con citrato muestran que, independientemente de la temperatura (23ºC o 37ºC) y de la concentración de citrato, la solución se mantiene estable durante 3 días.
En cuanto a la estabilidad física, las soluciones de vancomicina a concentraciones entre 1mg/mL y 5mg/mL con 22mg/mL y 40mg/mL de citrato sódico demostraron ser físicamente compatibles.
Mientras que en soluciones con vancomicina en concentraciones por encima de los 5mg/mL en combinación con heparina sódica por encima de las 5.000UI/mL, se ha observado que la solución antibiótica de sellado no es límpida. Aunque en algunos estudios se recoge que el precipitado se resuelve tras agitación.
Únicamente se han encontrado estudios de estabilidad de los valores de pH para las soluciones de sellado antibiótico de vancomicina con heparina. El valor de pH de la solución es un factor esencial en la actividad antimicrobiana. Efectivamente, el intervalo de valores de pH que favorece el crecimiento del S. aureus está entre 4 y 7, siendo el intervalo óptimo entre 6 y 7 a una temperatura de 37ºC, mientras que el intervalo de valores de pH óptimos para el crecimiento de S. epidermidis es 6-7 a 37ºC (70,71). En consecuencia, el control de los valores de pH de las soluciones de sellado a lo largo del tiempo en las condiciones de conservación y aplicación en el catéter es fundamental.
Con referencia a la actividad antimicrobiana, los estudios revisados indican que la combinación de vancomicina con heparina fue más efectiva para detener la proliferación del S. epidermidis, mientras que la solución de vancomicina sin heparina mostró mayor eficacia en la inhibición del crecimiento del S. aureus.
La combinación de vancomicina y citrato ofrece una alternativa no heparinizada. El citrato presenta una serie de bondades frente a la heparina como, por ejemplo, que presenta escasos efectos secundarios, una gran actividad antimicrobiana y es un agente quelante, que atrapa los iones de Mg²+ de la membrana celular desestabilizando la estructura de los microorganismos y es capaz de quelar a los iones de Ca²+ que intervienen en el crecimiento de las bacterias. Además, los sellados de citrato tienen un riesgo significativamente menor de episodios hemorrágicos en comparación con los sellados de heparina.
Por último, la revisión bibliográfica realizada en el presente trabajo lleva a recomendar la realización de estudios de estabilidad que aúnen la determinación de las características físico-químicas (apariencia, limpidez, valor de pH, y contenido en agente antimicrobiano) y la eficacia antimicrobiana en distintas condiciones de conservación y en condiciones de uso en el paciente dentro del catéter, para seleccionar de forma racional aquella solución de sellado de catéteres más idónea o establecer el periodo de validez en condiciones de conservación y en condiciones clínicas (dentro del catéter) de la solución de sellado a emplear. Aspectos especialmente importantes en catéteres cuya permanencia en el paciente es de larga duración, como es el caso de los reservorios subcutáneos.
5. REFERENCIAS
- Di Carlo I, Cordio S, La Greca G, et al. Totally implantable venous access devices implanted surgically: a retrospective study on early and late complications. Arch Surg. 2001;136:1050-3.
- Calvo R, Ruiz-Giménez JF, Rubio V, et al. Reservorios subcutáneos venosos centrales permanentes. Complicaciones. Rev Soc Esp Dolor. 2004;11:150-155.
- Manrique-Rodríguez S, Heras-Hidalgo I, Pernia-López MS, et al. Standardization and chemical characterization of intravenous therapy in adult patients: a step further in medication safety. Drugs RD. 2021;21:39-64. Disponible en: (https://doi.org/10.1007/s40268-020-00329-w).
- Raad I, Darouiche R, Dupuis J, et al. Central venous catheters coated with minocyclin and rifampin for the prevention of catheter-related colonization and bloodstream infections: A randomised double-blind trial. Ann Intern Med. 1997;127:267–274.
- Sandoval LJS, Lima FET, Gurgel SS, et al. Translation and cross-cultural adaptation of the instrument patient safety in pediatric drug administration: Spanish version. Esc Anna Nery. 2021;25(4):e2020033. Disponible en: (https://doi.org/10.1590/2177-9465-EAN-2020-0333).
- Bouza E. Intravascular catheter-related infections: A growing problem, the search for better solutions. Clin Microbiol Infect. 2002;8:530.
- CDC (Center of Diseases Control). National Nosocomial Infections Surveillance System. National Nosocomial Infections Surveillance (NNIS) System report, data summary from January 1992 through June 2004. Am J Infect Control. 2004;32:470–485.
- Knafelz D, Gambarara M, Diamanti A, et al. Complications of home parenteral nutrition in a large pediatric series. Transplant Proc. 2003;35(8):3050-1.
- Carvalho GC, Sábio RM, Spósito L, et al. An overview of the use of central venous catheters impregnated with drugs or with inorganic nanoparticles as a strategy in preventing infections. Int J Pharmaceutics. 2002;121:518.
- Dadi NC, Radochová B, Vargová J, et al. Impact of Healthcare-Associated Infections Connected to Medical Devices—An Update. Microorganisms. 2021;9(11):2332.
- Anttila VJ. Central venous catheter care for children with cancer should focus on early infections. Acta Pediatr. 2019;108(2):204-205. Disponible en: (https://doi.org/10.1111/apa.14548).
- Ardura MI. Overview of infections complicating pediatric hematopoietic cell transplantation. Infect Dis Clin North Am. 2018;32(1):237-252. Disponible en: (https://doi.org/10.1016/j.idc.2017.11.003).
- Torre FPF, Baldanzi G, Troster EJ. Risk factors for vascular catheter-related bloodstream infections in pediatric intensive care units. Rev Bras Ter Intensiva. 2018;30(4):436-442. Disponible en: (https://doi.org/10.5935/0103-507X.20180066).
- Higgins M, Zhang L, Ford R, et al. The microbial biofilm composition on peripherally inserted central catheters: a comparison of polyurethane and hydrophobic catheters collected from pediatric patients. J Vasc Access. 2021;22(3):388-393. Disponible en: (https://doi.org/10.1177/1129729820932423).
- Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections. Science. 1999;248:1318-22.
- Germán Díaz M, Moreno Villares JM, Gomis Muñoz P, et al. Bactericide and antibiotic lock therapy in pediatric patients with home parenteral nutrition. Update. Nutr Hosp. 2016;33(4):771-781. Disponible en: (http://dx.doi.org/10.20960/nh.369).
- Donlan RM. Biofilms: microbial life on surfaces. Emerg Infect Dis. 2002;8(9):881-90.
- Messing B, Peitra-Cohen S, Beliah M, et al. Antibiotic-lock technique: An approach to optimal therapy for catheter-related sepsis in home-parenteral nutrition patients. J Parenter Enteral Nutr. 1988;12:185–189.
- Qureshi S, Fatima P, Mukhtar A, et al. Clinical profile and outcome of antibiotic lock therapy for bloodstream infections in pediatric hematology/oncology patients in a tertiary care hospital, Karachi, Pakistan. Int J Pediatr Adolesc Med. 2019;6(1):25-28. Disponible en: (https://doi.org/10.1016/j.ijpam.2019.01.004).
- Bookstaver PB, Premnath P, Wright K, et al. Compatibility and stability of daptomycin lock solutions in combination with gentamicin, azithromycin, heparin and trisodium citrate. Preprints. 2019. Disponible en: (https://doi.org/10.20944/preprints201909.0107.v1).
- Liang H, Zhang L, Guo X, et al. Vancomycin-lock therapy for prevention of catheter-related bloodstream infection in very low body weight infants. BMC Pediatr. 2021;21(3). Disponible en: (https://doi.org/10.1186/s12887-020-02482-2).
- Ranch-Lundin M, Schedin A, Björkhem-Bergman L. Equal effect of vancomycin lock with or without heparin in treatment of central venous catheter related blood stream infections – an observational study in palliative home care. Infect Dis. 2021;53(9):719-723. Disponible en: (https://doi.org/10.1080/23744235.2021.1922752).
- Fincias Pérez M, Rollán de la Sota MJ, Álamo MM, et al. Estudio del uso del citrato para el sellado de catéteres en hemodiálisis. Rev Soc Esp Enferm Nefrol. 2008;11(4):319-322. Disponible en: (http://scielo.isciii.es/pdf/nefro/v11n4/carta.pdf).
- Fernández-Gallego J, Martín M, Gutiérrez E, et al. La profilaxis con sellado de gentamicina de las ramas del catéter venoso central crónico tunelizado no causa resistencia bacteriana. Nefrología. 2011;313:308-312. Disponible en: (http://www.scielo.isciii.es/scielo.php?pid=S021169952011000300011&script=sci_arttext).
- Baltrons Bosch A, Coll Vinyoles S, Font Senen C, et al. Estudio comparativo del sellado de catéteres con citrato trisódico o heparina sódica más gentamicina. Rev Soc Esp Enf Nefrol. 2008;11(2):95-100. Disponible en: (http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1139-13752008000200004).
- Aguinaga A, del Pozo JL. Infección asociada a catéter en hemodiálisis: diagnóstico, tratamiento y prevención. Nefro Plus. 2011;4(2):1-10. Disponible en: (http://www.revistanefrologia.com/es-publicacion-nefroplus-articulo-infeccion-asociada-cateter-hemodialisis-diagnóstico-tratamiento-prevencion-X1888970011001035).
- Büttner H, Mack D, Rohde H. Structural basis of Staphylococcus epidermidis biofilm formation: mechanisms and molecular interactions. Front Cell Infect Microbiol. 2015;5:14. Disponible en: (https://doi.org/10.3389/fcimb.2015.00014).
- Nuryastuti T. Staphylococcus epidermidis: how to turn from commensal to be a pathogen lifestyle. J Med Sci. 2018;50(1):113-27.
- Lee JY, Ko KS, Peck KR, et al. In vitro evaluation of the antibiotic lock technique (ALT) for the treatment of catheter-related infections caused by staphylococci. J Antimicrob Chemother. 2006;57:1110-5.
- Morales-Molina JA, Mateu-de Antonio J, Grau S, et al. La estabilidad como factor para considerar en las soluciones de sellado antibiótico. Enferm Infecc Microbiol Clin. 2010;28(2):104-109.
- DynaMed Plus. Ipswich (MA): EBSCO Information Services. 2018 – Record No. T146372, Central venous catheter; [updated 2018 Nov 30]. Disponible en: (https://www.dynamed.com/topics/dmp~AN~T146372). Registration and login required.
- López-Briz E, Ruiz Garcia V, Cabello JB, Bort-Martí S, Carbonell Sanchis R, Burls A. Heparin versus 0.9% sodium chloride locking for prevention of occlusion in central venous catheters in adults. Cochrane Database Syst Rev. 2018 Jul 30;7:CD008462. doi:10.1002/14651858.CD008462.pub3.
- Ciofu O, Moser C, Jensen PØ, et al. Tolerance and resistance of microbial biofilms. Nat Rev Microbiol. 2022;1-15.
- Pittiruti M, Bertoglio S, Scoppettuolo G, et al. Evidence-based criteria for the choice and the clinical use of the most appropriate lock solutions for central venous catheters (excluding dialysis catheters): a GAVeCeLT consensus. 2016. [DOI 10.5301/jva.5000576]
- Banco de Preguntas Preevid. Sellado de catéteres venosos centrales: con heparina o con soluciones antimicrobianas. Murciasalud 2019. Disponible en: (http://www.murciasalud.es/preevid/23044).
- Battistella M, Vercaigne LM, Cote D, et al. Antibiotic lock: in vitro stability of gentamicin and sodium citrate in dialysis catheters at 37 degrees C. Hemodial Int. 2010;14:322-326.
- Battistella M, Walker S, Law S, et al. Antibiotic lock: in vitro stability of vancomycin and four percent sodium citrate stored in dialysis catheters at 37 degrees C. Hemodial Int. 2009;13:322-328.
- Dotson B, Lynn S, Savakis K, et al. Physical compatibility of 4% sodium citrate with selected antimicrobial agents. Am J Health-Syst Pharm. 2010;67:1195-1198.
- Cote D, Lok CE, Battistella M, et al. Stability of Trisodium Citrate and Gentamicin Solution for Catheter Locks after Storage in Plastic Syringes at Room Temperature. Can J Hosp Pharm. 2010;63:304-311.
- Takla TA, Zelenitsky SA, Vercaigne LM. Effectiveness of a 30% ethanol/4% trisodium citrate locking solution in preventing biofilm formation by organisms causing haemodialysis catheter related infections. J Antimicrob Chemother. 2008;62:1024-1026.
- Trissel LA, editor. Handbook on injectable drugs. 14th ed. Bethesda: American Society of Health-System Pharmacists; 2007.
- Carratala J, Niubo J, Fernández-Sevilla A, et al. Randomized, double-blind trial of an antibiotic-lock technique for prevention of gram-positive central venous catheter-related infection in neutropenic patients with cancer. Antimicrob Agents Chemother. 1999; 43: 2200-2204.
- Garland JS, Alex CP, Henrickson KJ, et al. A vancomycin-heparin lock solution for prevention of nosocomial bloodstream infection in critically ill neonates with peripherally inserted central venous catheters: a prospective, randomized trial. Pediatrics. 2005; 116: 198-205.
- Fernández-Hidalgo N, Almirante B, Calleja R, et al. Antibiotic-lock therapy for long-term intravascular catheter related bacteraemia: results of an open, non-comparative study. J Antimicrob Chemother. 2006; 57: 1172-1180.
- Krishnasami Z, Carlton D, Bimbo L, et al. Management of hemodialysis catheter related bacteremia with an adjunctive antibiotic lock solution. Kidney Int. 2002; 61: 1136-1142.
- Rijnders BJ, Van Wijngaerden E, Vandecasteele SJ, et al. Treatment of long-term intravascular catheter related bacteraemia with antibiotic lock: randomized, placebo controlled trial. J Antimicrob Chemother. 2005; 55(1): 90-94.
- Fortune J, Grill F, Martin-Dávila P, et al. Treatment of longterm intravascular catheter-related bacteraemia with antibiotic-lock therapy. J Antimicrob Chemother. 2006; 58: 816-821.
- LaPlante KL, Mermel LA. In vitro activity of daptomycin and vancomycin lock solutions on staphylococcal Biofilms in a central venous catheter model. Nephrol Dial Transplant. 2007; 22: 2239-2246. Disponible en: (doi:10.1093/ndt/gfm141).
- Robinson JL, Tawfik G, Saxinger L, et al. Stability of heparin and physical compatibility of heparin/antibiotic solutions in concentrations appropriate for antibiotic lock therapy. J Antimicrob Chemother. 2005; 56: 951-953.
- Bastani B, Amin K, Herr A. Prolonged stability of stored vancomycin, gentamicin, and heparin for use in the antibiotic-lock technique. ASAIO J. 2005; 51: 761-763.
- Vercaigne LM, Sitar DS, Penner SB, et al. Antibiotic-heparin lock: in vitro antibiotic stability combined with heparin in a central venous catheter. Pharmacotherapy. 2000; 20: 394-9.
- Droste JC, Jeraj HA, McDonald A, et al. Stability and in vitro efficacy of antibiotic-heparin for lock solutions potentially useful for treatment of central venous catheter-related sepsis. J Antimicrob Chemother. 2003; 51: 849–855.
- Bookstaver PB, Rokas KEE, Norris LB, et al. Stability and compatibility of antimicrobial lock solutions. Am J Health-Syst Pharm. 2013; 70: 2185-2198.
- Programa de sellado antibiótico de catéteres intravenosos. Servicio de Farmacia – Unidad de Infecciosas. Hospital Universitario La Paz. Madrid.
- Protocolos de sellado de antibiótico del Hospital General Universitario de Alicante – Servicio de Farmacia.
- LaPlante KL, Woodmansee S, Mermel LA. Compatibility and stability of telavancin and vancomycin in heparin or sodium citrate lock solutions. Am J Health-Syst Pharm. 2012; 69: 1405-1409.
- Baker DS, Waldrop B, Arnold J. Compatibility and stability of cefotaxime, vancomycin, and ciprofloxacin in antibiotic lock solutions containing heparin. Int J Pharmaceutical Compound. 2010; 14(4): 346-349.
- Barros DP, Onofre PSC, Fonseca FLA, et al. Stability of vancomycin hydrochloride employed in antimicrobial seal solutions of central intravenous catheters. Rev. Latino-Am. Enfermagem. 2022; 30: e3621. Disponible en: (https://doi.org/10.1590/1518-8345.5869.3621).
- Luther MK, Mermel LA, LaPlante K. Comparison of telavancin and vancomycin lock solutions in eradication of biofilm-producing staphylococci and enterococci from central venous catheters. Am J Health-Syst Pharm. 2016; 73: 315-321. Disponible en: (20.2146/ajhp150029).
- Laplante KL, Mermel LA. In vitro activity of daptomycin and vancomycin lock solutions on staphylococcal biofilms in a central venous catheter model. Nephrol Dial Transplant. 2007; 22: 2239-2246.
- MacRae JM, Dojcinovic I, Djurdjev O, et al. Citrate 4% versus heparin and the reduction of thrombosis study (CHARTS). Clin J Am Soc Nephrol. 2008;3(2):369-374.
- Weijmer MC, Van den Dorpel MA, Van der Ven PJ, et al. CITRATE Study Group. Randomized, clinical trial comparison of trisodium citrate 30% and heparin as catheter-locking solution in hemodialysis patients. J Am Soc Nephrol. 2005;16(9):2769-2777. Disponible en: (https://doi.org/10.1681/ASN.2004100870).
- Grudzinski L, Quinan P, Kwok S, et al. Sodium citrate 4% locking solution for central venous dialysis catheters–an effective, more cost-efficient alternative to heparin. Nephrol Dial Transplant. 2007;22(2):471-476. Disponible en: (https://doi.org/10.1093/ndt/gfl606).
- Lok CE, Appleton D, Bhola C, et al. Trisodium citrate 4% – an alternative to heparin capping of hemodialysis catheters. Nephrol Dial Transplant. 2007;22(2):477-483.
- Power A, Duncan N, Singh SK, et al. Sodium citrate versus heparin catheter locks for cuffed central venous catheters: a single-center randomized controlled trial. Am J Kidney Dis. 2009;53(6):1034-1041.
- Venditto M, du Montcel ST, Robert J, et al. Effect of catheter lock solutions on catheter-related infection and inflammatory syndrome in hemodialysis patients: heparin versus citrate 46% versus heparin/gentamicin. Blood Purif. 2010;29(3):268-273.
- Bevilacqua JL, Gomes JG, Santos VFB, et al. Comparação entre citrato trissódico e heparina como solução para selo de catéter em pacientes em hemodiálise. J Bras Nefrol. 2011;33(1):86-92.
- Yon CK, Low CL. Sodium citrate 4% versus heparin as a lock solution in hemodialysis patients with central venous catheters. Am J Health Pharm. 2013;70(2):131-136.
- Boersma RS, Jie KS, Voogd AC, et al. Concentrated citrate locking in order to reduce the long-term complications of central venous catheters: a randomized controlled trial in patients with hematological malignancies. Support Care Cancer. 2015;23(1):37-45.
- The Food Safety Authority of Ireland (FSAI). Staphylococcus aureus. Disponible en: (https://www.fsai.ie/publications/factsheet//factsheet_Staphylococcus_aureus%20.pdf).
- Bojart RA, Holanda KT, Leeming JP, et al. Ácido aceláico: subcaptación y modo de acción en Staphylocccus epidermidis NCTC 11047. Revista de Bacteriología Aplicada. 1988;64(6):497-504.