Los óxidos de nitrógeno, monóxido y dióxido, denominados en la química ambiental como NOx, son gases contaminantes atmosféricos tóxicos de gran trascendencia para la salud. De esta manera, resulta preciso: a) su estudio estructural y el de sus propiedades, b) su control medio ambiental, sobre todo el de origen antropogénico y c) su relación entre concentración medioambiental y salud. En este trabajo, se aborda el estudio de la estructura molecular y propiedades relevantes de los NOx utilizando, esencialmente, herramientas de modelado molecular realizadas mediante el programa Spartan® 16.Palabras Clave: óxidos de nitrógeno; NOx; contaminación; modelado molecular.
ABSTRACT:
Nitrogen oxides (monoxide and dioxide) known in environmental chemistry as NOx are toxic atmospheric polluting gases of great importance for health. In this way, is necessary for NOx: a) structural study and properties, b) environmental control, in particular anthropogenic origin, c) relationship between environmental concentration and health. In this paper, molecular structure and significant properties of NOx is addressed, using molecular modeling tools carried out Spartan® 16 software.
Keywords: nitrogen oxides; NOx; pollution; molecular models.
1. INTRODUCCIÓN
El monóxido de nitrógeno, óxido de nitrógeno (II) u óxido nítrico (NO), es un gas incoloro, paramagnético, muy reactivo y que está presente en los mamíferos, donde realiza funciones de mensajero neuronal. Sin embargo, en concentraciones elevadas, se comporta como un tóxico, reduciendo la capacidad de transporte de la hemoglobina y mioglobina, irrita los ojos, garganta y vías respiratorias superiores y, en niveles muy altos, puede producir quemaduras de leves a graves, esencialmente en las vías respiratorias (1,2).
Por su parte, el óxido de nitrógeno (IV) o dióxido de nitrógeno (NO2), es un gas color fruto de café (tonalidad rojiza) y también es, como el anterior, paramagnético y de elevada reactividad. Como tóxico, se comporta en el ser humano, produciendo quemaduras, enfisema, sensación de ahogo, irritación de ojos, garganta y nariz, cansancio y náuseas (3).
Los NOx son contaminantes primarios, que pueden ser emitidos tanto por fuentes naturales, como antropogénicas (4).
Las fuentes naturales más importantes son los gases emitidos por las bacterias generadoras de nitrógeno, en los incendios forestales y por el vulcanismo.
Las fuentes antropogénicas, por su parte, se refieren a los escapes de los vehículos a motor, la quema de combustibles fósiles y los abonos nitrogenados.
Los NOx, tienen una serie de características comunes, son moléculas paramagnéticas, como hemos reseñado anteriormente, lo que les hace comportarse como radicales libres, aunque no lo son, pero tienen una alta reactividad propia de aquellos.
Como contaminantes primarios atmosféricos, presentan problemas de salud pública “per se”, como hemos indicado, pero también intervienen activamente en procesos de contaminación secundaria, como la destrucción de ozono en el denominado “agujero de ozono” a nivel estratosférico, formación de ozono troposférico o en la llamada lluvia ácida.
El objetivo de este trabajo es el de responder, utilizando las herramientas de modelado molecular, a preguntas que nos hemos hecho en química inorgánica respecto a los NOx. Para el NO, estas son: ¿El orden de enlace es de 2 o 2,5? ¿Qué potencial electrostático tiene la molécula? Para el NO2, lo son: ¿El ángulo de enlace es de 135°? ¿Qué potencial electrostático tiene la molécula? ¿Dónde se sitúa la nube electrónica del electrón no apareado? (5-7). Todo ello, es importante para comprender el mecanismo de actuación de los NOx en su contribución a la contaminación atmosférica.
El modelado molecular, también sirve para obtener las principales propiedades de las moléculas estudiadas, lo que contribuye a entender cómo se comportan estos óxidos y validar el modelo informático.
2. MATERIAL Y MÉTODOS
Se ha empleado el programa de modelado molecular Spartan® 16, Wavefunction, INC., para la obtención de las imágenes y propiedades de los NOx mostradas en este trabajo. Hemos utilizado dos metodologías de ese programa, Austin Model 1 (AM1) que es un método cuántico semiempírico, donde se usa el hamiltoniano y la función de onda, incluye parámetros para los átomos de nitrógeno y oxígeno, pero no se incluyen a los electrones internos y MØller Plesset (MP2/6-31G**), método ab initio, más preciso que el anterior, que tiene en cuenta los efectos de correlación de electrones y es una aproximación de la ecuación de onda. Los dos modelos de NOx, se han validado enfrentando los valores obtenidos en los cálculos termodinámicos por modelado molecular con los de la bibliografía; en este caso, consultando el CRC Handbook of Chemistry and Physics (8).
3. RESULTADOS Y DISCUSIÓN
3.1. Modelado molecular
Los resultados obtenidos en la validación de los modelos NOx, se muestran en la Tabla 1. Se observan en ella, resultados similares con respecto a los esperados en la bibliografía, por lo que consideramos el modelo “in silico” válido.
A partir de esa premisa, vamos a responder a las preguntas expuestas anteriormente empleando el método MP2/6-31G** “in silico”. Para el NO, la primera es sobre su orden de enlace. Se discute si éste es 2 o 2,5. La química clásica, considera que el orden es de 2,5 utilizando la clásica fórmula: número de electrones enlazantes menos el de antienlazantes y dividiendo el resultado entre 2. En nuestra opinión, eso sería correcto si el electrón desapareado contribuyese al enlace químico. Pero, como queda demostrado en el modelo “in silico”, no es así (Figura 1).
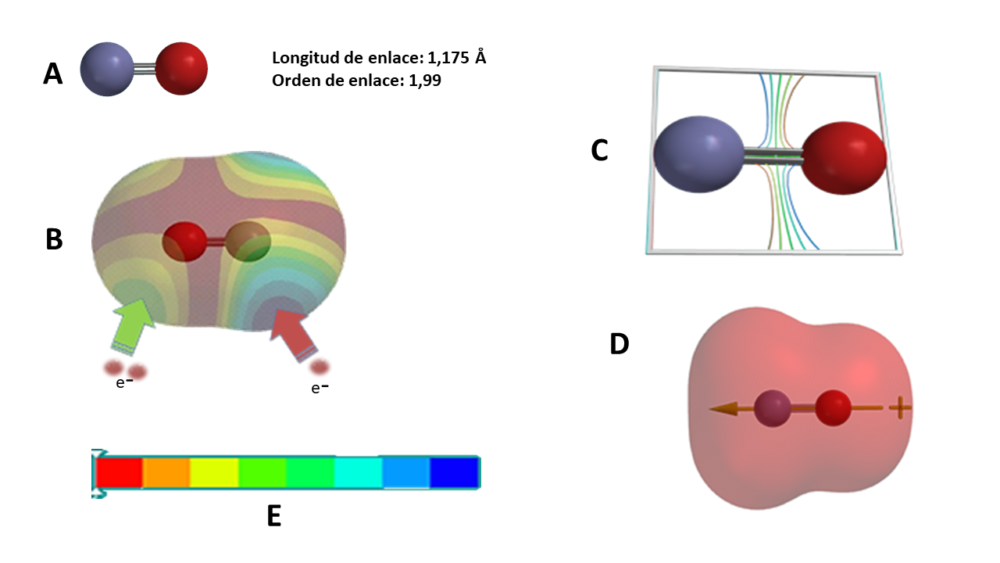
Figura 1. Modelo “in silico” del NO (MØller Plesset MP2/6-31G**). A) Estructura molecular y cálculo de la longitud y orden de enlace: rojo oxígeno, azul nitrógeno. B) Mapa de densidad electrónica de espín. C) Mapa de densidad electrónica de enlace. D) Mapa de potencial electrostático. E) Leyenda de los mapas B y D: rojo carga electrostática negativa, azul positivo.
Los resultados obtenidos “in silico”, nos muestran una longitud de enlace de 1,175 Å (figura 1A), que se corresponde con un doble enlace nitrógeno-oxígeno, cuyo valor medio es de 1,15 Å, mientras que el orden de enlace es de 1,99 que corresponde a un doble enlace. La densidad electrónica de los dos electrones del enlace se sitúa en la zona verde (figura 1B) que corresponde al oxígeno. Por su parte, la figura 1C, nos muestra la formación de enlaces covalentes entre los dos átomos. La figura 1B, nos muestra una zona azul correspondiente al electrón desapareado que se sitúa sobre el nitrógeno, lo que se refuerza con el mapa electrostático de la figura 1D, donde se puede observar que el vector del momento dipolar se dirige hacia el nitrógeno y no hacia el oxígeno como sería lo esperado por ser más electronegativo que el nitrógeno, por lo que el momento orbital que genera el electrón desapareado sobre el nitrógeno debe tener una mayor contribución al momento total que los del enlace y orbital del oxígeno.
En lo que respecta al potencial electrostático, según apreciamos en la figura 1D, es esencialmente negativo.
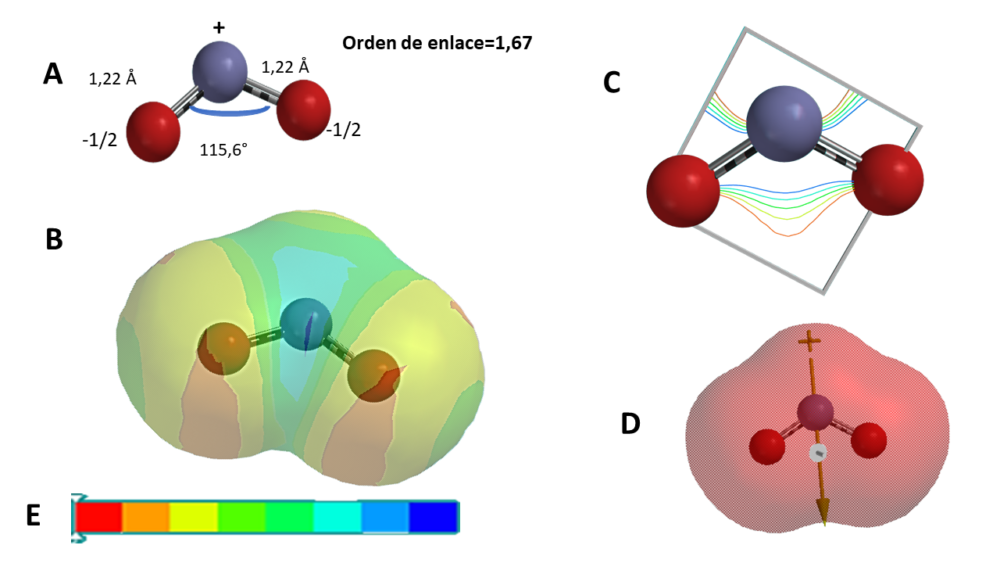
El NO2, por su parte, presenta un orden de enlace de 1,67 (figura 2A), lo que le sitúa entre un enlace sencillo y uno doble, lo que es típico de formas resonantes. La longitud de los dos enlaces nitrógeno-oxígeno, es idéntica y de 1,22 Å, superior a un doble enlace medio N-O (1,15 Å), pero inferior a un enlace sencillo (1,36 Å), compatible con una forma resonante ONO, cuyo valor medio se estima en 1,23 Å.
Figura 2. Modelo “in silico” del NO2 (MØller Plesset MP2/6-31G**). A) Estructura molecular y cálculo de la longitud y orden de enlace: rojo oxígeno, azul nitrógeno. B) Mapa de densidad electrónica de espín. C) Mapa de densidad electrónica de enlace. D) Mapa de potencial electrostático. E) Leyenda de los mapas B y D: rojo carga electrostática negativa, azul positivo.
Se ha estimado que el ángulo de enlace O-N-O sería de 135°. Sin embargo, el cálculo “in silico”, resulta ser de 115,6°, lo que es más acorde con una previsible hibridación sp2 del nitrógeno que resultaría en una geometría regular con un electrón desapareado y cuyo ángulo teórico sería de 120°. La perturbación electrónica del electrón desapareado puede resultar en un menor ángulo de enlace, como es el caso (115,6°).
La molécula de NO2, tiene un potencial electrostático como el del NO, esencialmente negativo, pero con el vector del momento dipolar dirigido hacia los átomos de oxígeno (figura 2D), lo que es corroborado por el mapa de densidad electrónica del enlace (figura 2C), donde hay una diferenciación muy clara entre los electrones del enlace dirigidos a los átomos de oxígeno de la forma resonante y el electrón desapareado en el nitrógeno predominando, en este caso, el momento de enlace y el orbital de los oxígenos sobre el orbital del nitrógeno, al contrario de lo visto en el NO.
Las diferencias son que en la molécula de NO2, el nitrógeno tiene un solo electrón sin compartir, mientras que en el NO tiene tres y que los dos átomos de oxígeno en el NO2 ejercen una doble atracción de la nube electrónica de enlace, con respecto al NO. Debido a ello, el valor del momento orbital hacia el nitrógeno en el NO2 será menor que en NO, mientras que será mayor el momento de enlace en el NO2 con respecto al NO. Sin embargo, las diferencias encontradas “in silico” en los momentos dipolares de 0,24 D para el NO2 y de 0,18 D para el NO, son poco significativas.
Finalmente, concluimos que el electrón desapareado se sitúa en el nitrógeno de la molécula de NO2, como ocurre en la de NO, según se puede apreciar en la figura 2B, donde la zona azul del electrón no enlazante se sitúa en el nitrógeno y las zonas rojas sobre los dos átomos de oxígeno, siendo estas últimas idénticas, lo que es indicativo de que el electrón de la forma resonante O-N-O se reparte por igual (½ matemáticamente) entre los dos átomos. Este hecho, se refuerza con el modelo de densidad electrónica de enlace (figura 2C), antes comentado.
3. 2. Contribución a la contaminación atmosférica de los NOx
Su contribución a la contaminación atmosférica se distingue a dos niveles cíclicos: troposférico y estratosférico.
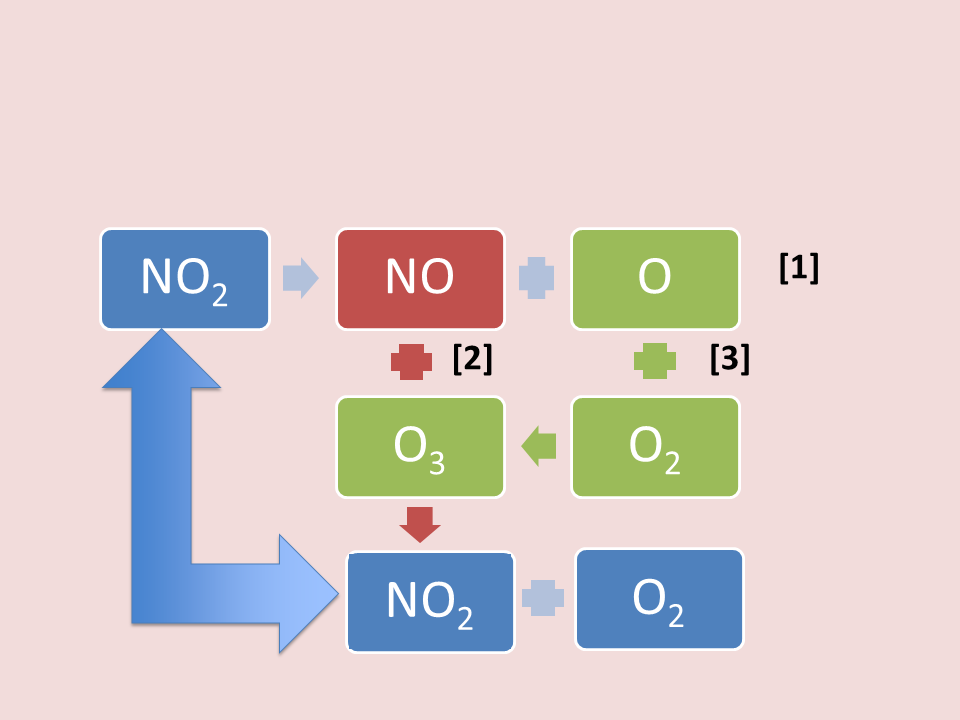
A nivel de la troposfera, los NOx pueden producir la formación y la destrucción del ozono troposférico mediante un ciclo de reacciones químicas. Este ciclo (figura 3), se inicia con el NO2 emitido a la atmósfera por sus fuentes de contaminación directas, el cual se descompone en óxido nítrico (NO) y oxígeno atómico (O)(1). El NO formado reacciona directamente con el ozono (2) para dar NO2 y O2, por lo que se destruyen las moléculas de ozono, cerrándose el ciclo con esa formación de NO2 a partir de la reacción (2) Sin embargo, también se puede crear ozono mediante la reacción (3), donde el oxígeno atómico de la reacción (1), reacciona con el oxígeno molecular (O2) para producir ozono. De esta manera, el NO2 resulta destructor y formador de moléculas de ozono, mientras que el NO, esencialmente, las destruye. Del equilibrio que se establezca en la atmósfera entre estos dos óxidos, dependerá el que se forme o se destruya el ozono troposférico, lo que es vital para la salud humana, ya que el ozono es un oxidante muy intenso de alta toxicidad, especialmente para los pulmones.
Figura 3. Ciclo de formación y descomposición de ozono troposférico por los NOx.
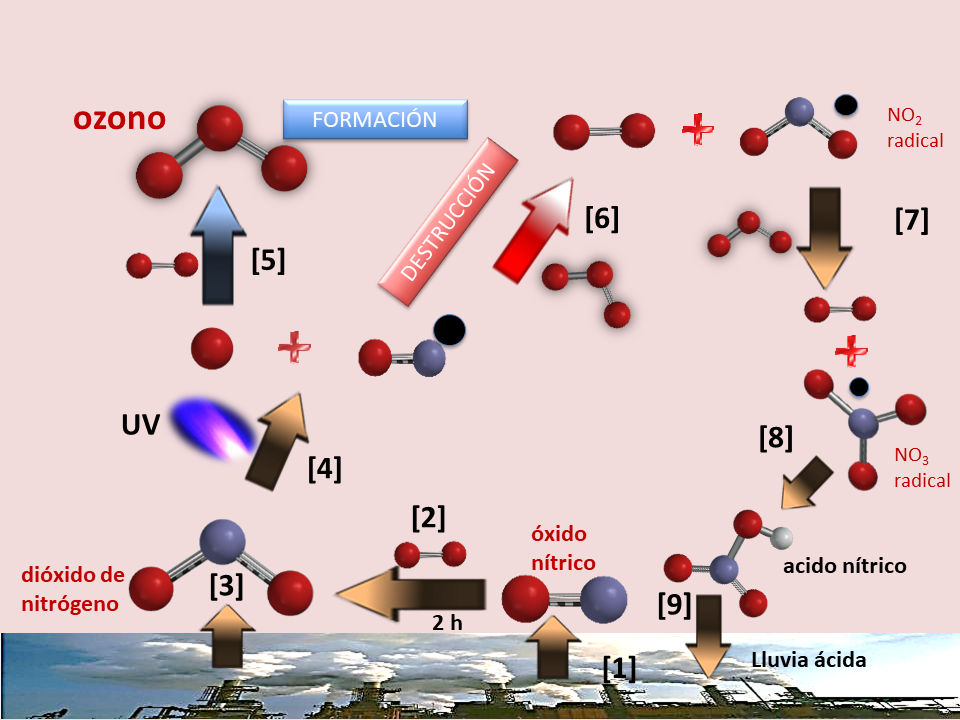
El ciclo descrito no requiere de catálisis alguna, pero también existe otro ciclo troposférico fotocatalítico, más complejo, donde intervienen los NOx y que se describe en la figura 4.
El óxido nítrico emitido (1) esencialmente por los vehículos de motor (9), en unas 2 horas se transforma en NO2, por reacción con el oxígeno atmosférico (2), al que se suma el emitido por sus propias fuentes de contaminación (3). El NO2, por acción fotocatalítica de la luz UV (4), forma un radical NO* muy reactivo y oxígeno atómico. Este último, reacciona con el oxígeno atómico atmosférico (5), resultando en la formación de ozono. Por su parte, el NO* de la reacción (4) reacciona directamente con el ozono (O3) y lo descompone en oxígeno molecular (O2) y en un radical NO*2 (6), también muy reactivo. Este radical, reacciona con el ozono(7), formando oxígeno molecular y un radical NO3*, por lo que se produce la destrucción de ozono como en la reacción (6).
Finalmente, el NO3*reacciona con el agua de las nubes (8), cuya reacción conduce a la formación de ácido nítrico (HNO3), uno de los constituyentes de la lluvia ácida, por lo que los NOx, mediante estas reacciones fotocatalíticas también contribuyen a la formación de esa contaminación secundaria (9).
Los bioquímicos dicen que el óxido nítrico es un radical. Sin embargo, como hemos podido apreciar en la figura 4, hemos distinguido las dos moléculas, NO y el NO* radical. La molécula de NO es paramagnética y muy reactiva, pero no es un radical. El NO* se forma en reacción fotocatalíticas y es aún más reactivo.
Si comparamos las dos moléculas utilizando un modelo “in silico”, nos da como resultado un valor diferencial de energía entre los orbitales LUMO y SOMO de 12,1 eV para el estado fundamental del NO y de 1,6 eV para su primer estado excitado NO*, siendo ambos positivos y, por tanto, muy reactivos, pero con una diferencia mucho menor entre esos orbitales en el caso del NO*, por lo debe resultar más reactivo este último. Lo mismo sucede entre el NO2 (14,1 eV) y el NO*2 (3,8 eV). La diferencia, consiste en que el electrón desapareado se sitúa en el nitrógeno de la molécula de NO, mientras que en el radical debe hacerlo sobre el oxígeno.
3. 3. Contribución al efecto invernadero y a la niebla fotoquímica
Los NOx tienen una capacidad como gases de efecto invernadero que es unas 300 veces más potente que el CO2. Los NOx también contribuyen a las nieblas fotoquímicas. Por estos motivos y los mostrados anteriormente, es importante su control, por lo que se actualizan constantemente en los inventarios de emisiones y se controlan por los servicios de contaminación atmosférica urbanos con estaciones de medida de NOx y otros contaminantes. Desde el espacio, se monitorizan las concentraciones de NO2 con satélites espaciales, como el proyecto Aura de la NASA, dentro de las mediadas de calidad del aire contempladas en ese proyecto (10).
3. 4. Contribución a la destrucción de ozono estratosférico
Su contribución, en este caso, se puede considerar limitada al NO2, que por reacción con ClO* va a constituir un importante reservorio de cloro en forma de ClONO2, ya que la destrucción del ozono estratosférico se produce en primavera por el cloro liberado desde esos depósitos (11-14).
En el invierno antártico, se producen en las nubes polares estratosféricas de la Antártida las siguientes reacciones:
Cl*(g)+ CH4(g) →HCl(g)+ CH3*(g)
ClO*(g) + NO2(g) →ClONO2(g)
El radical de cloro, proviene de los CFCs (fluorocarbonos). La segunda reacción elimina todo el NO2 de la atmósfera antártica. Se constituyen así, dos importantes depósitos que no reaccionan directamente con ozono, a temperaturas de -80 °C y menores. Durante el invierno, va reaccionando el ClONO2 con HCl y H2O a esas temperaturas, para dar lugar a Cl2 y HOCl, según las reacciones:
HCl + ClONO2 → Cl2 + HNO3 CATALIZADOR: HIELO
H2O + ClONO2 → HOCl (ácido hipocloroso) + HNO3
Cuando llega la primavera antártica y la luz hace su aparición, se liberan los depósitos de cloro mediante una reacción fotocatalítica en forma de Cl*, el cual es capaz de descomponer directamente al ozono, produciendo ClO* y O2.
Figura 4. Ciclo fotocatalítico de formación y descomposición de ozono troposférico por los NOx. Rojo oxígeno, azul nitrógeno, negro indica radical.
4. CONCLUSIONES
El orden de enlace de la molécula de NO es de 2, no tiene formas resonantes y su potencial electrostático es negativo. El ángulo de enlace de la molécula de NO2 es de 115,6°, tiene una configuración resonante y es, esencialmente, de potencial electrostático negativo como el NO. El electrón desapareado se sitúa sobre le nitrógeno en ambas moléculas, mientras que las nubes electrónicas de enlace lo hacen, preferentemente, sobre los átomos de oxígeno. Resulta así diferencias, aunque poco significativas del momento dipolar (0,24 D para el NO2 y 0,18 D para el NO).
Los NOx contribuyen a la formación y destrucción de ozono troposférico. La contribución de los NOx a la formación y destrucción atmosférica de ozono es importante. Se puede considerar que, el NO2 es destructor y creador de ozono y el NO solo destructor de ozono.
5. REFERENCIAS
1. Morrow, Paul E. Toxicological data on NO x: an overview. 1984.
2. Pickrell, John A., et al. Respiratory Toxicology Following Inhalation of NOx. 1982.
3. Shaw, Ian; Chadwick, John. Principles of environmental toxicology. CRC Press, 2018.
4. Shima, Masayuki. Health Effects of Air Pollution: A Historical Review and Present Status. Nihon eiseigaku zasshi. Japanese journal of hygiene, 2017, vol. 72, no 3, p. 159-165.
5. Shriver, Duward F.; Atkins, Peter William; LANGFORD, Cooper H. Química inorgánica. II. Reverté, 1998.
6. Sharpe, Alan G. Química inorgánica. Reverté, 1996.
7. Wells, Alexander Frank. Química inorgánica estructural. Reverte, 1978.
8. Haynes, William M.; Lide, David R.; Bruno, Thomas J. CRC handbook of chemistry and physics. CRC press, 2016.
9. Walsh, M. P. Mobile source related air pollution: effects on health and the environment. Encyclopedia of environmental health, 2011, vol. 3, p. 803-809.
10. Barnett, J. J., et al. Mapping the optical obscuration in the NASA Aura HIRDLS instrument. En Infrared Spaceborne Remote Sensing 2005. SPIE, 2005. p. 103-112.
11. Stolarski, Richard S. The Antarctic ozone hole. Scientific American, 1988, vol. 258, no 1, p. 30-37.
12. Solomon, Susan. The mystery of the Antarctic ozone “hole”. Reviews of Geophysics, 1988, vol. 26, no 1, p. 131-148.
13. Godin, Sophie. Ozone Hole. En Encyclopedia of Astronomy & Astrophysics. CRC Press, 2001. p. 1-4.
14. Turco, Richard P.; TOON, Owen B.; HAMILL, Patrick. Heterogeneous physicochemistry of the polar ozone hole. Journal of Geophysical Research: Atmospheres, 1989, vol. 94, no D14, p. 16493-16510.