1. ENFERMEDAD DE ALZHEIMER
1.1. Introducción
La enfermedad de Alzheimer (EA) se encuentra dentro de las enfermedades neurodegenerativas de progresión lenta, siendo considerada la forma más común de demencia en personas mayores de 65 años (1). En 2020, representó entre el 60 y el 70 % de todos los casos de demencia en el mundo, lo que equivale a entre 30 y 35 millones de personas a nivel global, con 6-7 millones de nuevos pacientes por año (2-3). Se espera que estos números aumenten con el tiempo, superando los 66 millones para 2030 y alcanzando casi 100 millones para el año 2050 (4-5), debido al envejecimiento de la población, especialmente en los países desarrollados. La principal causa de EA es la acumulación anormal de proteínas en el cerebro, principalmente la proteína beta amiloide (Aβ) y la proteína tau hiperfosforilada (p-tau) que da lugar a que se formen placas neuríticas extracelulares y ovillos neurofibrilares (6) de manera progresiva e irreversible. Este proceso interfiere con la comunicación entre las células cerebrales, lo que resulta en la degeneración neuronal y los síntomas característicos de la enfermedad (7-9). Hoy en día, el diagnóstico de Alzheimer se realiza mediante una combinación de evaluaciones clínicas, pruebas neuropsicológicas y análisis de imágenes cerebrales y la exclusión de otras posibles causas de los síntomas. Además, su diagnóstico definitivo se realiza post mortem a través de una biopsia cerebral (10). No existe una cura para la enfermedad de Alzheimer, pero hay tratamientos que pueden ralentizar su progresión y mejorar la calidad de vida del paciente. En general, los síntomas son visibles de forma tardía, cuando ya se encuentra comprometido más del 50 % del sistema nervioso central. Por ello, conseguir métodos de diagnóstico que permitan una detección temprana de la enfermedad es clave para intervenir de manera efectiva, ofrecer un mejor pronóstico y ralentizar la progresión de la misma.
1.2. Biomarcadores relacionados con la enfermedad de Alzheimer
Una de las principales líneas de investigación actuales se enfoca en la detección de biomarcadores proteicos, los cuales brindan información clave sobre la EA. Estos biomarcadores permiten identificar cambios patológicos en fases tempranas, incluso antes de que los síntomas clínicos se hagan evidentes. Entre los biomarcadores más relevantes se encuentran la proteína Aβ, cuya acumulación en cerebro es uno de los sellos distintivos de la enfermedad, y la proteína tau, que forma ovillos neurofibrilares que reflejan la degeneración neuronal. La proteína Aβ es un pequeño residuo de 39 a 43 aminoácidos derivados de la proteína precursora de amiloide ubicada en el cerebro (11); entre estas se destacan los monómeros constituidos por Aβ42 (Aβ con 42 aminoácidos) y Aβ40 (Aβ con 40 aminoácidos) (12). Ciertos estudios in vitro revelan que la neurotoxicidad se asocia con la producción de fragmentos de proteína Aβ capaces de agregarse en forma de oligómeros, fibrillas y finalmente convirtiéndose en placas amiloides. Entre estos, los fragmentos de oligómero beta amiloide (AβO), formas solubles de la proteína consideradas altamente neurotóxicas (13), cobran especial relevancia como biomarcadores potenciales, ya que pueden circular en fluidos biológicos (6). Diversos estudios relacionan niveles anormales de AβO en líquido cefalorraquídeo (LCR), sangre o tejido cerebral con el avance de la enfermedad (14). Además, la acumulación de AβO puede detectarse hasta 20 años antes de la aparición de los primeros síntomas (15). Estos oligómeros proteicos interfieren con la función sináptica e inducen estrés oxidativo causante del daño celular y muerte neuronal. También se cree que los AβO desencadenan la fosforilación de los microtúbulos, lo que impide la transmisión de señales entre las neuronas y, finalmente, induce daño neuronal. Por lo tanto, AβO han sido reconocidos como biomarcadores moleculares objetivos terapéuticos para el diagnóstico de la enfermedad de Alzheimer.
1.3. Técnicas analíticas para el diagnóstico de la enfermedad de Alzheimer
El diagnóstico de EA se apoya en diversas técnicas analíticas que permiten detectar cambios patológicos en el cerebro y realizar una evaluación precisa de la condición del paciente. La resonancia magnética permite observar la atrofia cerebral y la tomografía por emisión de positrones permite visualizar la acumulación de placas de beta-amiloide y ovillos de tau en el cerebro, características fundamentales de la enfermedad. Centrándonos en el análisis de biomarcadores proteicos en fluidos biológicos, se han aplicado diferentes técnicas analíticas tales como microscopía de fluorescencia (16), electroquimioluminiscencia (17), ensayos de inmunoadsorción ligado a enzimas (18-19) y espectroscopía Raman (20), entre otras. Sin embargo, estos métodos en general son altamente complejos y costosos, consumen mucho tiempo y requieren instrumentación sofisticada. Por estas razones, la búsqueda de técnicas más avanzadas para mejorar la sensibilidad, selectividad y simplicidad del método ha sido explorada, siendo los biosensores métodos alternativos efectivos gracias a sus propiedades analíticas, tales como técnica no invasiva, de bajo costo, altamente sensible, con posibilidad de automatización y miniaturización (21). Estas técnicas analíticas, utilizadas en conjunto, permiten un diagnóstico más preciso y temprano de la enfermedad usando muestras poco invasivas como el plasma, lo que es fundamental para implementar estrategias terapéuticas oportunas y así mejorar la calidad de vida de los pacientes.
2. BIOSENSORES ELECTROQUÍMICOS: UN ENFOQUE DIAGNÓSTICO INNOVADOR DE LA ENFERMEDAD DE ALZHEIMER
2.1. Introducción
Los biosensores son dispositivos analíticos formados por un elemento de reconocimiento biológico unido a un transductor fisicoquímico que produce una señal biológica como consecuencia de la interacción específica de la diana de interés (analito) al bioreceptor, y convirtiéndola en una señal analítica proporcional a la concentración de analito (22). Los biosensores pueden clasificarse de múltiples formas en función del tipo de elemento de reconocimiento biológico, sistema de transducción, mecanismo de interacción, entre otras. Según el tipo de transductor utilizado, pueden clasificarse como transductores electroquímicos, ópticos, piezoeléctricos y térmicos, que convierten una señal biológica en una señal medible de acuerdo con el principio físico que emplea.
En los biosensores electroquímicos, el elemento de reconocimiento biológico y el elemento de transducción deben estar en contacto directo para producir una señal eléctrica (23). En la actualidad se están diseñando y desarrollando biosensores electroquímicos como métodos analíticos para la detección y cuantificación de biomarcadores relevantes en EA, por las ventajas exclusivas que ofrecen frente a otros biosensores, como son su alta sensibilidad, especificidad, bajas interferencias, simplicidad, bajo costo, facilidad de integración en sistemas portátiles o capacidad de trabajar con líquidos opacos, como puede ser la sangre. Por tanto, son dispositivos analíticos con gran potencial en el campo clínico, capaces de detectar biomarcadores proteicos a bajas concentraciones y en muestras complejas, permitiendo un diagnóstico de la enfermedad precoz antes de la aparición de los síntomas.
2.2. Generalidades en el desarrollo de biosensores electroquímicos para la detección de oligómeros de la proteína beta-amiloide
Como se ha comentado anteriormente, los biosensores electroquímicos irrumpen como herramientas analíticas altamente prometedoras para el diagnóstico temprano de la EA, gracias a su capacidad para detectar biomarcadores proteicos propios de la enfermedad. En particular, se han diseñado y desarrollado diversos biosensores electroquímicos enfocados en la detección de oligómeros de la proteína beta-amiloide, biomarcador neurotóxico y soluble, que circula en fluidos biológicos y desempeña un papel crucial en la progresión de la enfermedad.
En la literatura se han descrito biosensores electroquímicos mediante el uso de diferentes elementos de bioreconocimiento del AβO, siendo los más utilizados los aptámeros y la proteína priónica celular (PrPc). El gen PRNP se ha revelado como un gen asociado a una mayor susceptibilidad a la enfermedad de Alzheimer (24). La PrPc, codificada por el gen PRNP, se encuentra de forma abundante en el sistema nervioso central. Por un lado, hay estudios que atribuyen a PrPc un papel neuroprotector por modulación indirecta de la síntesis de Aβ, pero por otro lado se conoce como un receptor de los oligómeros beta amiloide, por lo que diversos estudios han evidenciado que la interacción PrPc-AβO parece ser crítica para la toxicidad neuronal (25). En cuanto a los aptámeros, son secuencias sencillas de ADN o ARN capaces de unirse a su diana con gran afinidad (26). A los aptámeros se los conoce como anticuerpos químicos debido a que son similares a estos, monoclonales y capaces de reconocer a antígenos; además, presentan diversas ventajas; entre ellas destaca su menor tamaño que los anticuerpos, su síntesis química menos costosa y con menos variabilidad y facilidad de modificación sin pérdida de actividad (27). Considerando estas ventajas, los aptámeros se han utilizado satisfactoriamente como bioreceptores de AβO.
El sistema de inmovilización de la biomolécula es fundamental en el desarrollo de biosensores, ya que influye en la estabilidad, la eficiencia y la sensibilidad del dispositivo analítico. En este sentido, en el diseño de estos biosensores se han utilizado distintas estrategias, como pueden ser: matrices poliméricas por su alta estabilidad y facilidad de fabricación; gran variedad de nanomateriales, como nanopartículas de oro, plata, grafeno o nanotubos de carbono, que presentan ventajas interesantes como su gran área superficial, permitiendo una alta densidad de inmovilización de moléculas biológicas y la mejora de la conductividad eléctrica, facilitando la transferencia de electrones.
En la etapa de detección electroquímica, se pueden distinguir dispositivos analíticos con o sin etapa de marcaje. La principal diferencia entre estos radica en la forma en que se realiza la medición y el tipo de interacción que se utiliza para detectar el analito. En los biosensores sin marcaje, la señal electroquímica se genera directamente a partir de la interacción analito-receptor biológico, mientras que en los biosensores con marcaje se detecta la presencia de analito a través de una señal eléctrica que se genera tras un proceso de marcaje, generalmente enzimático. Los biosensores sin etapa de marcaje presentan claras ventajas, como son la reducción de las etapas de ensayo, así como de reactivos utilizados, lo que simplifica el proceso, disminuye el tiempo de análisis y el coste del dispositivo analítico. Además, poseen menor riesgo de interferencias, mejorando la precisión y fiabilidad de los resultados, y mayor estabilidad a largo plazo. Considerando lo anteriormente relacionado, la revisión bibliográfica se centrará en biosensores electroquímicos libres de marcaje.
La técnica electroquímica más utilizada en los biosensores desarrollados ha sido la Espectroscopia de Impedancia Electroquímica, ESI. La técnica ESI analiza las propiedades eléctricas de diferentes materiales dentro de una celda electroquímica, traduciendo cambios en las propiedades interfaciales entre el electrodo y el electrolito, tras la modificación de la superficie electródica, en una señal eléctrica. Por tanto, el uso de esta técnica electroquímica permite el diseño de biosensores libres de marcaje, estudiándose la interacción analito-elemento de biorreconocimiento mediante cambios en el parámetro de resistencia a la transferencia de carga (Rct) de una sonda redox (28).
La mayoría de los estudios se han centrado en el análisis de muestras sintéticas, y solo algunos han validado el método analítico con muestras reales de pacientes con enfermedad de Alzheimer o sospecha de la misma. Sin embargo, el análisis en muestras reales es crucial, ya que permite verificar la precisión y aplicabilidad del método analítico en condiciones clínicas auténticas, lo que mejora su potencial para un diagnóstico temprano y un manejo más efectivo de la enfermedad.
2.3. Nuevas fronteras en el diagnóstico de la enfermedad de Alzheimer: avances en el diseño de biosensores electroquímicos
Los avances en biosensores electroquímicos han permitido el desarrollo de plataformas biosensóricas altamente sensibles y precisas para la detección de oligómeros de beta-amiloide. En este contexto, esta revisión se centrará en investigaciones que abordan el diseño de biosensores electroquímicos libres de marcaje, debido a las ventajas anteriormente mencionadas. Estos biosensores, que utilizan aptámeros o PrPc como elementos de bioreconocimiento, han mostrado propiedades analíticas notables para la detección de AβO tanto en muestras sintéticas como en muestras de pacientes de EA. En la Tabla 1, se presentan los biosensores electroquímicos desarrollados en los últimos 10 años para la detección de AβO, todos libres de marcajes, detallando el tipo de técnica electroquímica utilizada, las propiedades analíticas más relevantes y el tipo de muestra analizada en cada caso.
Tabla 1. Biosensores electroquímicos libres de marcaje para la detección de AβO en la enfermedad de Alzheimer
APTS (3- amino propil trietoxisilano), AuD (dendritas de oro), AuNPs (nanopartículas de oro), AuS ( nano estrellas de oro), COOH (grupo funcional carboxilo), EIS (espectroscopia de impedancia electroquímica), IDC (electrónico interdigitado capacitativo), IL (intervalo lineal), LD (límite de detección), LSV (voltamperometría de barrido lineal), MCH (6,Mercaptohexanol), MMGO-AuNPs (micromotores tubulares catalíticos de grafeno con nanopartículas de oro), NP (nanopartículas), PEDOT (Poli(3,4-etilendioxitiofeno)-poli (estireno sulfonato)), POPA (polytyramine/poly 3-(4-hydroxyphenyl propionic acid), PrPC (proteína priónica celular),Pt (platino), PTAA (polímero de poli (triarilamina)), rod (nano hilos), SiO2 (dióxido silico), SPCE (electrodo serigrafiado de carbono), Ti (titanio).
Diversos autores han diseñado y desarrollado biosensores electroquímicos libres de marcaje utilizando el péptido sintético compuesto por los residuos 95-110 de PrPc como bioreceptor, para el análisis de oligómeros de beta amiloide en muestras sintéticas. Rushworth y colaboradores en 2014 (29) desarrollaron un biosensor impedimétrico utilizando como transductor electrodos de oro funcionalizados con un copolímero derivado de una mezcla de tiramina y su análogo ácido carboxílico, el ácido 3-(4-hidroxifenil) propiónico (POPA). La unión de PrPc se llevó a cabo mediante la interacción de alta afinidad biotina/neutravidina. Para ello, después de una electropolimerización sobre la superficie electródica, se produjo una incubación con electrodos recubiertos con éster de N-hidroxisuccinimida-biotina, seguida de una incubación con neutravidina y finalmente con PrPc biotinilado durante 30 minutos. El biosensor desarrollado mostró buena precisión en la detección de AβO y alta especificidad sin respuesta significativa a monómeros ni fibrillas de proteína Aβ. Además, se obtuvo un bajo límite de detección (0,5 pM). El biosensor se aplicó satisfactoriamente a la detección de oligómero beta amiloide en un modelo celular de ovario de hámster.
Posteriormente, Xing y colaboradores en 2017 desarrollaron un biosensor voltamperométrico mediante la unión del péptido PrPc a un electrodo de oro a través de monocapas autoensambladas (30). El mecanismo de detección de AβO se basó en un proceso de inhibición de ensamblaje de nanopartículas de oro utilizadas como indicadores redox. En concreto, en presencia del péptido PrP inmovilizado en la superficie electródica, pero en ausencia de oligómero, se desencadenaba la formación in situ de agregados de nanopartículas de plata (AgNP) en la superficie electródica, produciéndose una señal electroquímica bien definida. Sin embargo, la unión específica AβO-PrP impidió el ensamblaje in situ de las AgNP al electrodo, dando como resultado una disminución significativa de la señal electroquímica. Con esta metodología se lograron límites de detección de 6 pM y un tiempo de análisis inferior a 30 minutos. En los estudios de especificidad realizados con monómeros, fibrillas y proteínas interferentes como albúmina sérica bovina, IgG y trombina, se demostró la alta especificidad del dispositivo desarrollado frente a AβO. Al igual que en el primer estudio, el biosensor se validó con muestras artificiales, en este caso de líquido cefalorraquídeo y sueros enriquecidos, obteniéndose un porcentaje de recuperación entre 86% y 109%.
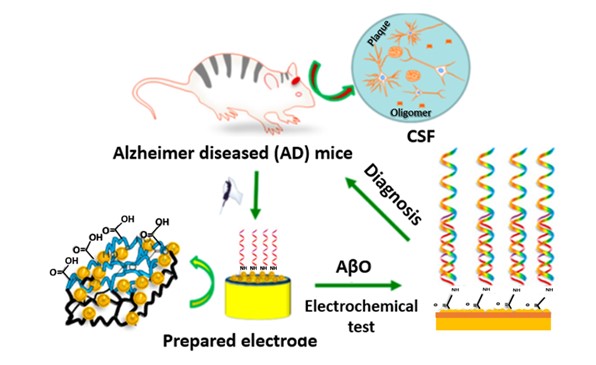
Qin y colaboradores, en 2019 (31), desarrollaron un biosensor libre de marcaje mediante el uso de polímeros como sistema de inmovilización de PrPC. La fabricación del biosensor consistió en la electrodeposición de una capa delgada de poli(3,4-etileno dioxi-tiofeno) (PEDOT) incrustada con nanopartículas de oro (AuNPs−PEDOT) para obtener alta conductividad y una gran área superficial del sustrato, seguida del depósito electroquímico de poli(ácido tiofeno-3-acético) (PTAA) para la inmovilización del bioreceptor PrPC a través de los grupos NH2 (Figura 1). El biosensor fabricado mostró una alta estabilidad y un límite de detección extremadamente bajo a nivel fentomolar, con un amplio rango de detección de 10-8 a 10⁴ nM en la detección de AβO. Su utilidad se demostró midiendo AβO en LCR de ratones contaminados con EA, obteniéndose porcentajes de recuperación próximos a 100 % (99,1-102 %) con una adecuada precisión (CV < 5 %).
Figura 1. Etapas en la preparación de un biosensor basado en AuNPs-PEDOT-PTAA-PrPc para la detección de AβO en LCR de ratones. Reproducido con autorización de (31). Copyright (2019) American Chemical Society.
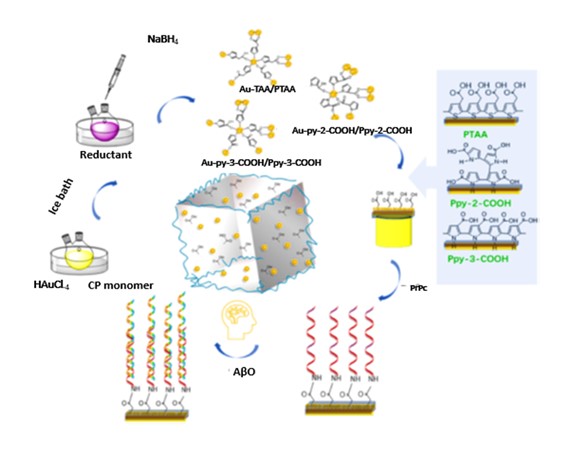
Un año más tarde, los mismos autores diseñaron otro biosensor también basado en el empleo de matrices poliméricas (32). Se preparó electroquímicamente una dendrita jerárquica de oro (AuD) sobre un sustrato de oro y se electrodepositó ácido polipirrol-3-carboxílico [PPy-3-COOH], dando lugar a un sistema de alta conductividad y gran área superficial. Se utilizó PrPc como bioreceptor como en los artículos previos, pero en este caso se llevó a cabo la inmovilización de PrPc mediante la formación de enlaces amida para conseguir una mayor estabilidad. La respuesta de impedancia del biosensor dendrítico PPy-3-COOH/PrPC mostró una relación proporcional al aumento de la concentración de AβO desde 10-9 hasta 10 nM con un límite de detección de 1 aM. El biosensor fue estable durante un mes y se demostró la selectividad del biosensor frente a otras biomoléculas. Se llevó a cabo el análisis de muestras cerebrales y LCR en ratones portadores de Alzheimer y en muestras de sangre artificiales, obteniéndose recuperaciones entre 99,5 % y 101 %.
Un estudio más reciente, desarrollado por Zhao y colaboradores en 2022 (33), se basó en un método impedimétrico para la determinación del AβO en muestras de ratones. Utilizaron como sistema de inmovilización una capa conductora 3D con nanopartículas de oro (AuNPs) incrustadas en diferentes polímeros conductores (Figura 2). Estos polímeros, por un lado, actuaban como estabilizadores para la correcta dispersión de nanopartículas de oro y, además, servían de enlace para la inmovilización de PrPc mediante la formación de enlaces amida. Compararon las propiedades analíticas de biosensores con diversos polímeros Ppy-3-COOH (polietileno (ácido tiofeno-3-acético), poli (ácido pirrol-2-carboxílico) y poli (ácido pirrol-3-carboxílico), obteniéndose un amplio intervalo de estudio (10-9 a 103 nM) con el biosensor PrPC/AuNPs-E-Ppy-3-COOH (Figura 2). Se obtuvo alta selectividad en la detección de AβO frente a monómeros y fibrillas, así como una buena estabilidad (30 días conservado a 4°C). Además, se utilizó satisfactoriamente en el análisis de muestras de líquido cefalorraquídeo y sangre de ratones.
Figura 2. Etapas en el diseño de un biosensor electroquímico basado en AuNPs incrustadas en diferentes matrices poliméricas conductoras para la detección de AβO en LCR y sangre de ratones. Reproducido con autorización de (33). CC BY-NC-ND license.
Wang y colaboradores (34) desarrollaron un biosensor electroquímico basado en nanoestrellas de oro (AuS) funcionalizadas con una sonda peptídica PrPc, para la detección de AβO mediante EIS. Se obtuvieron cambios significativos en la impedancia al unirse AβO a la superficie PrPc-AuS, proporcionando información cuantitativa sobre el biomarcador, llegando a un límite de detección de 2 pM. En las pruebas de especificidad no hubo interferencias significativas de monómeros o fibrillas de Aβ. Aunque se destaca la sencillez de fabricación de la plataforma biosensórica, el dispositivo analítico no se validó en muestras sintéticas.
Otros autores han utilizado las ventajas que ofrecen los aptámeros como elementos de bioreconocimiento. En este sentido, Zhang y colaboradores, en 2019, desarrollaron un biosensor electroquímico basado en medidas de EIS para la detección del AβO en LCR artificial (35). Como biorreceptor se utilizó un aptámero tiolado específico de AβO que se autoensambló sobre electrodos modificados con nanohilos de oro (Au-rod) a través de interacciones Au-S, consiguiendo una unión estable del aptámero. Posteriormente, se produjo la unión específica del AβO y se midió la concentración de oligómero tras un tiempo de incubación de 40 minutos. Se obtuvo un límite de detección de 0,03 pM con alta precisión. Para demostrar la aplicabilidad del dispositivo desarrollado, se realizó un estudio de recuperación mediante la contaminación de muestras de LCR artificial enriquecido con cantidades conocidas de AβO (1 nM, 20 nM y 100 nM), obteniéndose valores de recuperación próximos a 100 %. Se realizaron pruebas de interferencia con diferentes especies de Aβ, observándose una alta selectividad del sensor hacia los AβO, sin cambios significativos hacia los monómeros o fibrillas.
Un aspecto clave en el desarrollo de un método analítico es la validación del mismo mediante muestras reales, lo cual constituye un reto complicado. Esto se debe a que este tipo de muestras, como sangre o LCR de pacientes, pueden contener una variedad de interferentes biológicos y matrices complejas que dificultan la obtención de una medida precisa y la interpretación de los resultados. Además, las condiciones in vivo son mucho más dinámicas y variables en comparación con los entornos controlados de laboratorio. Por lo tanto, la validación en muestras reales es esencial para demostrar la eficacia y la aplicabilidad del biosensor en situaciones clínicas o de diagnóstico, y es un desafío significativo en el desarrollo de estos dispositivos. Aunque no hay un valor de corte entre los niveles de AβO entre personas sanas y pacientes con Alzheimer, y los estudios directos sobre los niveles de AβO en muestras reales en las distintas etapas de la EA son limitados, la baja concentración de Aβ en el LCR y sangre sugiere que los niveles de AβO también serán bajos, especialmente en las primeras etapas de la EA. Según la literatura, se indica que el intervalo de concentración de AβO en sangre y LCR de pacientes con EA se encuentra en el intervalo de 5.5 y 200 pM (34, 36-37). En otros estudios se observaron órdenes de magnitud similares en tejido cerebral (38). Considerando estos niveles, la detección de AβO es particularmente difícil, ya que se encuentra muy por debajo de los límites de detección de muchas técnicas convencionales. En este sentido, un reto es lograr metodologías altamente sensibles que permitan la detección precisa de AβO, por lo que diversos autores han desarrollado biosensores electroquímicos, no solo logrando límites de detección adecuados para este fin, sino aplicando las bioplataformas al análisis de muestras complejas humanas.
En 2023, Sharma y colaboradores (39) desarrollaron un biosensor electrónico interdigitado capacitativo (IDC) basado en un chip de platino disperso sobre un soporte de titanio y silicio (Pt/Ti-SiO2), modificado con APTS (3-aminopropiltrietoxisilano) para mejorar las propiedades de adhesión (Pt/Ti-SiO2-APTS). La correcta funcionalización de la superficie electródica del chip con el elemento de biorreconocimiento (aptámero o anticuerpo específico de AβO) se realizó mediante microscopía de fuerza atómica (AFM) y microscopía electrónica de barrido (SEM). Los chips ensamblados con aptámero poseían una morfología más homogénea que aquellos ensamblados con anticuerpos, cuya morfología era más rugosa e irregular. Para probar la sensibilidad de las dos bioplataformas, IDC-anticuerpo o IDC-aptámero, se midió la capacitancia con concentraciones sucesivas de AβO (0,1 × 105-1,0 μg ml-1). Con la inmunoplataforma IDC-anticuerpo se lograron resultados cuantitativos en tan solo 3 segundos después de un único paso de incubación. Para IDC-aptámero, se requirieron dos etapas de incubación (APTS-AβO), observándose el cambio a los pocos segundos, y con mayor sensibilidad. Por ello, utilizaron como biomolécula aptámero conjugado con ATPS, consiguiendo de esta manera una estructura secundaria del aptámero con alta afinidad al oligómero beta amiloide (AβO). El biosensor IDC-aptámero presentó como características analíticas más relevantes un amplio intervalo lineal de 10-8 -1,0 μg mL-1 con un bajo límite de detección (0.1 fg mL-1). Con el fin de evaluar la posibilidad de análisis de muestras reales con el dispositivo desarrollado, se analizaron muestras de plasma de 20 pacientes, los cuales previamente habían confirmado ser enfermos de Alzheimer a través de métodos convencionales. Con la bioplataforma IDC-aptámero se observaron diferencias en los valores de capacitancia para personas sanas y pacientes con Alzheimer, pudiendo llevar a cabo un análisis cuantitativo a partir de 5 µL de muestra en un tiempo de detección de 5 a 6 segundos. Los autores lograron desarrollar un chip con una alta selectividad, alta sensibilidad, un procesamiento rápido, bajo costo y buena reutilización para la detección de AβO en muestras de plasma de pacientes con EA. La principal desventaja de este estudio es que la muestra a analizar debe estar altamente diluida, lo que podría ser un problema para realizar pruebas in situ.
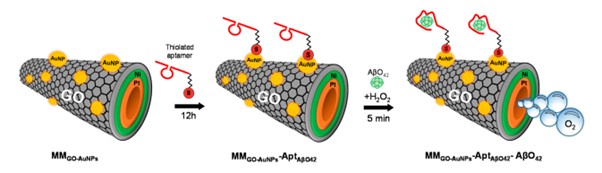
Uno de los estudios más recientes, descrito por Gallo-Orive y colaboradores en 2024 (40), desarrollado por la Universidad Complutense de Madrid y la Universidad de Alcalá, propone el diseño de una plataforma biosensórica mediante el uso de micromotores tubulares catalíticos (MM). Los MM son objetos a microescala que convierten la energía química o un estímulo externo en propulsión autónoma. El movimiento autónomo de los MM facilita la mezcla eficiente de fluidos, obteniéndose reacciones químicas más rápidas y, por lo tanto, una detección ultrasensible en poco tiempo. Se sintetizaron MM de grafeno-níquel-platino funcionalizados con nanopartículas de oro (MMGO-AuNPs). Como elemento de biorreconocimiento se utilizó un aptámero tiolado específico de AβO42 que se inmovilizó en MMGO-AuNPs por medio de interacciones Au-S. Posteriormente, se llevó a cabo una etapa de bloqueo con BSA para asegurar que el AβO42 solo se uniese al aptámero inmovilizado en la superficie electródica. Para llevar a cabo la medida cuantitativa del analito, solo se requirió un volumen de 5 µL que contenía AβO42 (patrón o muestra real sin dilución) y peróxido de hidrógeno (2%) como combustible para la propulsión de los MM (Figura 3). Tras 5 min de búsqueda de los MM a la proteína diana, se paraba el movimiento y se realizaba la medida electroquímica sin marcaje mediante voltamperometría de onda cuadrada.
Esta bioplataforma electroquímica presentó excelentes propiedades analíticas, como son alta selectividad y precisión (CV < 8 %), amplio intervalo lineal (0,5 y 500 pg mL-1) y alta sensibilidad (LD 0,1 pg mL-1) para la detección de AβO42, con un tiempo de análisis de 5 minutos y bajo volumen de muestra. Además, el intervalo lineal obtenido con el aptasensor cubre los niveles clínicos, permitiendo la determinación directa de AβO42 sin dilución, simplificando el análisis. El biosensor desarrollado se validó satisfactoriamente para la detección de AβO42 en pacientes sanos y en muestras clínicas complejas de pacientes con EA, tales como LCR, tejido cerebral y plasma, obteniéndose porcentajes de recuperación entre 95 y 102 %. Además, se determinaron los niveles de AβO42 presentes en muestras reales de pacientes diagnosticados de EA, y los resultados obtenidos usando el aptaensayo electroquímico se compararon con el método estándar utilizado en la fundación CIEN (Centro de Investigación de Enfermedades Neurológicas) en términos cualitativos, obteniéndose resultados similares. La bioplataforma desarrollada muestra alta competitividad frente a la metodología utilizada en la fundación para la determinación de AβO42, ya que esta última requiere de 5 a 15 µg de proteína y mayor tiempo de análisis (>12 h) para proporcionar resultados únicamente cualitativos.
Figura 3.- Etapas del desarrollo de una plataforma biosensórica basada en micromotores catalíticos de grafeno con AuNPs para la detección de AβO en LCR, tejido cerebral y plasma de pacientes con EA. Reproducido con autorización de (40). Copyright (2024) American Chemical Society. CC-BY 4.0 license.
3. PERSPECTIVAS FUTURAS Y RETOS EN EL DESARROLLO DE BIOSENSORES ELECTROQUÍMICOS PARA LA DETECCIÓN DE LA ENFERMEDAD DE ALZHEIMER
Los biosensores electroquímicos muestran un gran potencial como dispositivos analíticos para la detección de oligómeros de beta-amiloide como consecuencia de sus propiedades analíticas, tales como alta sensibilidad, especificidad, bajo coste, posibilidad de medidas in situ, entre otras. Sin embargo, superar los desafíos relacionados con la validación en muestras reales y su integración en plataformas clínicas sigue siendo crucial para su éxito en el diagnóstico temprano y el seguimiento de la EA. La implementación de esta tecnología en el ámbito del diagnóstico clínico aún está en sus primeras etapas, y deben superarse diversos desafíos. Por un lado, se debe promover una colaboración efectiva con hospitales y entidades interesadas en transferir la tecnología biosensórica y, por otro, será necesario que el personal sanitario amplíe su conocimiento sobre esta tecnología y cómo implementarla en su práctica clínica, especialmente en diagnósticos con baja disponibilidad de muestras clínicas donde la posible miniaturización de los biosensores cobra especial relevancia.
Un reto importante es la integración de biosensores electroquímicos con plataformas de diagnóstico clínico en tiempo real y en el punto de atención (POC, por sus siglas en inglés). Esto implica no solo mejorar la sensibilidad y selectividad, sino también garantizar la facilidad de uso, la portabilidad y la capacidad de realizar análisis rápidos y precisos en entornos clínicos o en el hogar.
La validación de los biosensores en muestras reales, como la sangre o el líquido cefalorraquídeo de pacientes con EA, sigue siendo un desafío crítico. Las muestras biológicas humanas son altamente complejas, con diversas matrices que pueden interferir en las medidas. Además, las concentraciones de AβO pueden variar entre individuos y en diferentes estadios de la enfermedad, lo que requiere de metodologías altamente sensibles. Para el diagnóstico temprano y el seguimiento de la progresión de la EA, sería ideal que los biosensores pudieran proporcionar mediciones en tiempo real y en estudios longitudinales. Esto permitiría un monitoreo más efectivo de la progresión de la enfermedad y la respuesta al tratamiento, lo que representa una necesidad en el campo de la neurociencia clínica.
Otro desafío importante es hacerlos económicamente viables para su producción a gran escala y su implementación en ensayos clínicos masivos. Esto incluye optimizar la fabricación de dispositivos de bajo costo que puedan ser utilizados ampliamente en hospitales y centros de salud.
Si bien el AβO está estrechamente asociado con la enfermedad de Alzheimer, otros trastornos neurodegenerativos, como el Parkinson o las enfermedades priónicas, también pueden implicar la formación de agregados proteicos. Los biosensores electroquímicos que detectan AβO pueden ampliarse para detectar agregados proteicos de otras enfermedades, lo que abriría nuevas aplicaciones para estos dispositivos.
4. CONCLUSIONES
La enfermedad de Alzheimer es una enfermedad neurodegenerativa incurable, cuyo diagnóstico se basa en el uso de técnicas convencionales, costosas y complejas, como pruebas cognitivas detalladas, análisis de imágenes cerebrales mediante resonancia magnética o tomografía por emisión de positrones, que identifican cambios en el cerebro relacionados con la enfermedad. Sin embargo, el diagnóstico temprano sigue siendo un desafío importante, ya que los síntomas iniciales pueden ser sutiles y confundirse con el envejecimiento normal o trastornos cognitivos leves. Por tanto, el desarrollo de nuevas metodologías analíticas que permitan el diagnóstico de la enfermedad en etapas tempranas es necesario, pudiendo de esta manera intervenir de manera efectiva, ofreciendo un mejor pronóstico y calidad de vida de los pacientes. En este sentido, un campo de estudio es la detección de biomarcadores biológicos que evidencien la enfermedad de Alzheimer en etapas tempranas, antes de que se manifiesten síntomas clínicos.
Los biosensores electroquímicos se presentan como una metodología prometedora gracias a sus excelentes propiedades analíticas, tales como especificidad, sensibilidad, rapidez, así como posibilidad de miniaturización y automatización. Hasta el día de hoy, se han desarrollado diversos biosensores electroquímicos libres de marcaje mediante el estudio de diferentes sistemas de inmovilización como nanomateriales y polímeros con la finalidad de mejorar la sensibilidad y especificidad en la detección de AβO, permitiendo la detección de concentraciones bajas de este biomarcador en muestras biológicas. Gracias a su capacidad para proporcionar resultados rápidos y no invasivos, los biosensores están abriendo nuevas posibilidades para el diagnóstico temprano y el estudio de la progresión de la enfermedad, facilitando intervenciones más eficaces.
Se han diseñado y desarrollado diferentes bioensayos electroquímicos para la determinación de oligómeros beta-amiloides, con resultados favorables para el diagnóstico de la enfermedad de Alzheimer, permitiendo determinaciones con un bajo límite de detección adecuado para el análisis de muestras clínicas reales, utilizando en algunos casos bajos volúmenes de muestra. Las bioplataformas desarrolladas se utilizaron para el análisis de gran variedad de muestras como tejido cerebral, LCR humano, plasma humano, LCR de ratones, LCR artificial o sueros enriquecidos. Como elementos de bioreconocimiento del oligómero beta-amiloide se han utilizado mayoritariamente aptámeros y proteína pirónica celular. Los diferentes biosensores desarrollados poseen distintos tiempos de ensayo, siendo el tiempo mínimo de 5-6 segundos para la determinación de la molécula diana (39) y el tiempo máximo de 1 hora (33). Todas las bioplataformas electroquímicas desarrolladas se caracterizaron por ser técnicas no invasivas y con gran posibilidad de realizar análisis in vivo e in situ, permitiendo el diagnóstico en etapas tempranas y de manera precisa, convirtiéndolas en herramientas futuras para escenarios de rutina clínica, pero solo en pocos casos los dispositivos han sido validados con muestras reales de pacientes con Alzheimer (39-40).
5. REFERENCIAS
- Tao D, Shui B, Gu Y, Cheng J, Zhang W, Jaffrezic-Renault N, et al. Development of a label-free electrochemical aptasensor for the detection of Tau381 and its preliminary application in AD and non-AD patients’ sera. Biosens. 2019;9(3):84. doi.org/10.3390/bios9030084.
- World Health Organization. Dementia. 15 March 2023. Available from: https://www.who.int/news-room/fact-sheets/detail/dementia.
- Bomasang-Layno E, Bronsther R. Diagnosis and treatment of Alzheimer’s disease: An update. Dela J Public Health. 2021;7(4):74–85. doi:10.32481/djph.2021.09.009.
- Liu L, Chang Y, Yu J, Jiang M, Xia N. Two-in-one polydopamine nanospheres for fluorescent determination of beta-amyloid oligomers and inhibition of beta-amyloid aggregation. Sens Actuators B Chem. 2017;251:359–65. doi.org/10.1016/j.snb.2017.05.106.
- Calabró M, Rinaldi C, Santoro G, Crisafulli C. The biological pathways of Alzheimer disease: A review. AIMS Neurosci. 2021;8:86–132. doi:10.3934/Neuroscience.2021005.
- Jamerlan A, An SSA, Hulme J. Advances in amyloid beta oligomer detection applications in Alzheimer’s disease. TrAC Trends Anal Chem. 2020;129:115919. doi.org/10.1016/j.trac.2020.115919.
- Qin J, Park JS, Jo DG, Cho M, Lee Y. Curcumin-based electrochemical sensor of amyloid-β oligomer for the early detection of Alzheimer’s disease. Sens Actuators B Chem. 2018;273:1593–9. doi.org/10.1016/j.snb.2017.05.106.
- Lane C, Hardy J, Schott JM. Alzheimer’s disease. Eur J Neurol. 2018;25(1):59–70. doi:10.1111/ene.13439.
- Olazarán J, Hoyos-Alonso M, Ser TD, Barral AG, Conde-Sala J, Bermejo-Pareja F, et al. Practical application of brief cognitive tests. Neurología. 2016;31(3):183–94. doi:10.1016/j.nrl.2015.07.009.
- Montero-Calle A, San Segundo-Acosta P, Garranzo-Asensio M, Rábano A, Barderas R. The molecular misreading of APP and UBB induces a humoral immune response in Alzheimer’s disease patients with diagnostic ability. Mol Neurobiol. 2020;57:1009–20. doi.org/10.1007/s12035-019-01809-0.
- Toledo JB, Xie SX, Trojanowski JQ, Shaw LM. Longitudinal change in CSF Tau and Aβ biomarkers for up to 48 months in ADNI. Acta Neuropathol. 2013;126:659–70. doi.org/10.1007/s00401-013-1151-4.
- Scarano S, Lisi S, Ravelet C, Peyrin E, Minunni M. Detecting Alzheimer’s disease biomarkers: From antibodies to new bio-mimetic receptors and their application to established and emerging bioanalytical platforms – A critical review. Anal Chim Acta. 2016;940:21–37. doi.org/10.1016/j.aca.2016.08.008.
- Shankar GM, Li S, Mehta TH, Garcia-Munoz A, Shepardson NE, Smith I, et al. Amyloid-β protein dimers isolated directly from Alzheimer’s brains impair synaptic plasticity and memory. Nat Med. 2008;14:837–42. doi.org/10.1038/nm1782.
- Janeiro MH, Ardanaz CG, Sola-Sevilla N, Dong J, Cortés-Erice M, Solas M, et al. Biomarcadores en la enfermedad de Alzheimer. Adv Lab Med. 2021;2(1):39–50. doi.org/10.1515/almed-2020-0109.
- Frisoni GB, Ritchie C, Carrera E, Nilsson P, Ousset PJ, Luimolinuevo J, et al. Re-aligning scientific and lay narratives of Alzheimer’s disease. Lancet Neurol. 2019;18(10):918–9. doi:10.1016/S1474-4422(19)30323-0.
- Teoh CL, Su D, Sahu S, Yun SW, Drummond E, Cho S, et al. Chemical fluorescent probe for detection of Aβ oligomers. J Am Chem Soc. 2015;137(2):13503–9. doi.org/10.1021/jacs.5b06190.
- Liu H, Zhou X, Shen Q, Xing D. Paper-based electrochemiluminescence sensor for highly sensitive detection of amyloid-β oligomerization: Toward potential diagnosis of Alzheimer’s disease. Theranostics. 2018;8(8):2289–99. doi:10.7150/thno.23483.
- Kim H, Lee S, Choi I. On-chip plasmonic immunoassay based on targeted assembly of gold nanoplasmonic particles. Analyst. 2019;144:2820–6. doi.org/10.1039/C8AN02489H.
- Yang T, O’Malley D, Kanmmert J, Jerecic L, Zieske R, Zetterberg H, et al. A highly sensitive novel immunoassay specifically detects low levels of soluble Aβ oligomers in human cerebrospinal fluid. Alzheimers Res Ther. 2015;7(1):14. doi:10.1186/s13195-015-0100-y.
- Polykretis P, Banchelli M, D’Andrea C, De Angelis M, Matteini P. Raman spectroscopy techniques for the investigation and diagnosis of Alzheimer’s disease. Front Biosci (Schol Ed). 2022;14(3):22. doi:10.31083/j.fbs1403022.
- Shui B, Tao D, Flore A, Cheng J, Zhao Q, Gu Y, et al. Biosensors for Alzheimer’s disease biomarker detection: A review. Biochimie. 2018;147:13–24. doi:10.1016/j.biochi.2017.12.015.
- Rumayor VG, Iglesias EG, Galán OR, Cabezas LG. Aplicación de los biosensores en la industria agroalimentaria. Informe de Vigilancia y Tecnología. 2005:1–119.
- Bhalla N, Jolly P, Formisano N, Estrela P. Introduction to biosensors. Essays Biochem. 2016;60(1):1–8. doi:10.1042/EBC20150001.
- Bertram L, Tanzi R. Thirty years of Alzheimer’s disease genetics: The implications of systematic meta-analyses. Nat Rev Neurosci. 2008;9(10):768–78. doi:10.1038/nrn2494.
- Fulek M, Hachiya N, Gachowska M, Beszłej JA, Bartoszewska E, Kurpas D, et al. Cellular prion protein and amyloid-β oligomers in Alzheimer’s disease—Are there connections? Int J Mol Sci. 2025;26:2097. doi.org/10.3390/ijms26052097.
- Ospina D. Los aptámeros como novedosa herramienta diagnóstica y terapéutica y su potencial uso en parasitología. Biomedica. 2020;40(Suppl 1):148–66. doi:10.7705/biomedica.4765.
- Rozenblum GT, Lopez VG, Vitullo AD, Radrizzani M. Aptamers: Current challenges and future prospects. Expert Opin Drug Discov. 2016;11(2):127–35. doi.org/10.1517/17460441.2016.1126244.
- Caicedo-Eraso J, Díaz-Arango F. Electrical impedance spectroscopy applied to quality control in the food industry. Cienc Tecnol Agropecuaria. 2020;21:e951.
- Rushworth JV, Ahmed A, Griffiths HH, Pollock NM, Hooper NM, Millner PA. A label-free electrical impedimetric biosensor for the specific detection of Alzheimer’s amyloid-beta oligomers. Biosens Bioelectron. 2014;56:83–90. doi.org/10.1016/j.bios.2013.12.036.
- Xing Y, Feng XZ, Zhang L, Hou J, Han GC, Chen Z. A sensitive and selective electrochemical biosensor for the determination of beta-amyloid oligomer by inhibiting the peptide-triggered in situ assembly of silver nanoparticles. Int J Nanomedicine. 2017;12:3171–9. doi:10.2147/IJN.S132776.
- Qin J, Cho M, Lee Y. Ultrasensitive detection of amyloid β using cellular prion protein on the highly conductive Au nanoparticles–poly(3,4-ethylene dioxythiophene)–poly(thiophene-3-acetic acid) composite electrode. Anal
- Chem. 2019;91(17):11259–65. doi.org/10.1021/acs.analchem.9b02266.
- Qin J, Kim S, Cho M, Lee Y. Hierarchical and ultra-sensitive amyloid beta oligomer sensor for practical applications. Chem Eng J. 2020;401:126055. doi.org/10.1016/j.cej.2020.126055.
- Zhao C, Wang A, Tang C, Qin J. Electrochemical sensitive detection of amyloid-β oligomer harnessing cellular prion protein on AuNPs embedded poly(pyrrole-3-carboxylic acid) matrix. Mater Today Adv. 2022;14:100250. doi.org/10.1016/j.mtadv.2022.100250.
- Wang P, Chen S, Guan Y, Li Y, Jiamali A. An electrochemical sensing platform based on gold nanostars for the detection of Alzheimer’s disease marker Aβ oligomers (Aβo). Alex Eng J. 2023;81:1–6. doi:10.1016/j.aej.2023.08.073.
- Zhang Y, Figueroa-Miranda G, Lyu Z, Zafiu C, Willbold D, Offenhäusser A, Mayer D. Monitoring amyloid-β proteins aggregation based on label-free aptasensor. Sens Actuators B Chem. 2019;288:535–42. doi.org/10.1016/j.snb.2019.03.049.
- Hölttá M, Hansson O, Andreasson U, Hertze J, Minthon L, Nägga K, et al. Evaluating amyloid-β oligomers in cerebrospinal fluid as a biomarker for Alzheimer’s disease. PLoS One. 2013;8:e66381.
- Santos AN, Ewers M, Minthon L, Simm A, Silber R, Blennow K, et al. Amyloid-β oligomers in cerebrospinal fluid are associated with cognitive decline in patients with Alzheimer’s disease. J Alzheimers Dis. 2012;29:171–6. doi:10.3233/JAD-2012-111361.
- Xia W, Yang T, Shankar G, Smith IM, Shen Y, Walsh DM, Selkoe D. A specific enzyme-linked immunosorbent assay for measuring beta-amyloid protein oligomers in human plasma and brain tissue of patients with Alzheimer disease. Arch Neurol. 2009;66:190–9. doi:10.1001/archneurol.2008.565.
- Sharma PK, Kim ES, Mishra S, Ganbold E, Seong RS, Kim YM, et al. Ultrasensitive probeless capacitive biosensor for amyloid beta (Aβ1–42) detection in human plasma using interdigitated electrodes. Biosens Bioelectron. 2022;212:114365. doi.org/10.1016/j.bios.2022.114365.
- Gallo-Orive A, Moreno-Guzmán M, Sanchez-Paniagua M, Montero-Calle A, Barderas R, Escarpa A. Gold nanoparticle-decorated catalytic micromotor-based aptassay for rapid electrochemical label-free amyloid-β42 oligomer determination in clinical samples from Alzheimer’s patients. Anal Chem. 2024;96:5509–18. doi.org/10.1021/acs.analchem.3c05665.