1. INTRODUCCIÓN
El avance científico es el resultado de un esfuerzo múltiple que no solo busca lo nunca visto sino, sobre todo, comprender. Ver no es igual que observar; observar no es lo mismo que entender; entender no es lo mismo que comprender. Son procesos necesariamente progresivos del conocimiento que, sin embargo, deben ser entendidos de forma retroactiva o circular, porque comprender nos lleva siempre a volver a ver – ahora ya con otros ojos – lo que anteriormente creíamos conocer. Como dijo Erwin Schrödinger, “la tarea no es tanto ver lo que nadie ha visto todavía, sino pensar lo que nadie ha pensado todavía sobre lo que todos ven”. Si Santiago Ramón y Cajal no hubiera “visto con otros ojos” la compleja estructura neuronal del sistema nervioso seguramente la evolución de la fisiología, de la anatomía y, en general, de la medicina – y de la veterinaria – habría sufrido un considerable retraso, con obvios efectos deletéreos sobre la humanidad y sobre el resto de seres vivos; y, lo que no es menos relevante, sobre el conocimiento.
Así pues, una parte notable del esfuerzo investigador de los científicos y de las instituciones académicas y empresariales que lo soportan va encaminado a revaluar eso que creíamos saber y que, en realidad, solo era el simple resplandor de una superficie a veces deslumbrante pero que suele encubrir un profundo y desconocido océano de realidad. En el ámbito de la biomedicina, la reevaluación continua ha permitido ver con actitud diferente lo que siempre ha estado delante de nuestros ojos; gran parte de los medicamentos procedentes de la química sintética, la biotecnología y las terapias avanzadas (genética, somática, ingeniería tisular, etc.) son un ejemplo patente de todo lo dicho.
Por innovación terapéutica puede entenderse cualquier mejora de un nuevo producto o procedimiento clínico de uno o varios aspectos de interés farmacoterapéutico, en el grado que sea, con relación a los medicamentos, usos terapéuticos o procedimientos disponibles actualmente (1). Posiblemente, los principales elementos responsables de la limitación para la incorporación de nuevos medicamentos innovadores al ámbito de la medicina personalizada son la rentabilidad de la inversión en la investigación, la dificultad para determinar la efectividad terapéutica (en especial los ensayos clínicos), así como la volatilidad del reembolso económico de la inversión realizada debido a las limitaciones impuestas por la sostenibilidad económica de los sistemas sanitarios públicos y la regulación legal de los medicamentos.
No es preciso resaltar a estas alturas la trascendencia – desde muchas perspectivas – de la innovación de los medicamentos “novedosos”, es decir, con nuevas sustancias o con nuevas indicaciones terapéuticas que se incorporan al uso clínico general. Desde una visión estrictamente científica, ofrece la oportunidad de calibrar y consolidar el avance del conocimiento de cómo los medicamentos actúan y cuál es su impacto real sobre los sistemas vivos y, en particular, sobre los seres humanos. Desde una perspectiva de salud pública, el valor de los medicamentos radica en su valor terapéutico y los beneficios para la salud que pueden generar para los pacientes, así como para la sociedad: años de vida salvada, mejora de la calidad de vida, mejor tolerabilidad, reducción de jornadas laborales perdidas, etc. Igualmente, desde una perspectiva empresarial la innovación de los medicamentos podría valorarse en función del éxito de las ventas del laboratorio titular. Sin embargo, la medida de la innovación terapéutica es particularmente trascendental – y urgente – para las decisiones relativas a la autorización, comercialización y, en su caso, financiación pública de los nuevos fármacos – o de aquellos antiguos con nuevas indicaciones – a la prestación farmacéutica de los sistemas públicos de salud, tanto en el ámbito comunitario como en hospitalario.
2. NUEVAS INDICACIONES TERAPÉUTICAS PARA MEDICAMENTOS YA AUTORIZADOS: CONCEPTOS Y PROCEDIMIENTOS EN LA EMA
En la Unión Europea es la European Medicines Agency (EMA) el organismo público comisionado para informar y asesorar a la Comisión Europea para la autorización centralizada de medicamentos, tanto de aquellos con nuevas entidades químicas, bioquímicas, celulares o de cualquier otro tipo, como de cualquier modificación o variación de las previamente autorizadas, por el motivo que sea.
En 2022, la EMA recomendó para su autorización de comercialización 41 medicamentos de uso humano que tenían una nueva sustancia activa que nunca antes había sido autorizada en la UE. Frente a ellas, se recomendaron favorablemente 90 extensiones de indicación, incluidas 37 para uso pediátrico. Es decir, hubo más del doble de nuevas indicaciones terapéuticas o extensiones de algunas anteriores que nuevos medicamentos (con sus correspondientes indicaciones) autorizados incluyendo alguna nueva sustancia activa (2). En esta misma línea, la Food & Drug Administration (FDA) de Estados Unidos aprobó, también en 2022, 37 nuevos medicamentos nunca antes aprobados ni comercializados, pero asimismo autorizó “nuevos entornos” para medicamentos previamente aprobados, entre ellos 25 nuevas indicaciones y 12 extensiones para poblaciones de pacientes pediátricos (3).
La elevada cantidad de autorizaciones de nuevas indicaciones o de sus extensiones o modificaciones por parte de la EMA y de la FDA, en relación con la de medicamentos con nuevos principios activos, pone de relieve que la investigación farmacológica – básica y clínica – no acaba con la autorización de comercialización de un medicamento sino que, al contrario, son muchos los que siguen siendo objeto de una extensa e intensiva investigación por parte de sus laboratorios titulares con el fin de extraer el máximo de conocimiento y de resultados sanitarios de una productos cuyo desarrollo tiene un muy alto coste económico y que requiere amplios y multidisciplinares equipos humanos investigadores.
Existe una reglamentación en la Unión Europea que clasifica las variaciones en razón de su importancia y de sus repercusiones. En este sentido, el Reglamento (CE) nº 1234/2008 de la Comisión Europea define una variación de tipo II en el registro centralizado de medicamentos europeos como una variación importante que puede tener un impacto significativo en la calidad, seguridad o eficacia de un medicamento (4). En concreto, en su artículo 19 (Extensiones de las autorizaciones de comercialización) establece que “una solicitud de extensión de una autorización de comercialización se evaluará con arreglo al mismo procedimiento que la autorización original de comercialización correspondiente”, y que “se concederá una autorización de comercialización a una extensión con arreglo al mismo procedimiento que la autorización original de comercialización correspondiente, o bien la extensión se incluirá en dicha autorización de comercialización”; todo lo cual enfatiza la importancia que da a esta forma de innovación.
En su Anexo II (Clasificación de las modificaciones) se indica, entre otras, que se clasificarán como modificaciones de importancia mayor de tipo II aquellas relativas a la adición de una nueva indicación terapéutica o a la modificación de una existente y a cambios significativos del resumen de características – ficha técnica – del producto que sean debidos, en particular, a nuevos resultados cualitativos preclínicos, clínicos o de farmacovigilancia.
Dentro de la EMA, el Comité de Medicamentos de Uso Humano (Committee for Medicinal Products for Human Use; CHMP) es responsable de realizar la evaluación inicial de las solicitudes de autorización centralizada de comercialización en toda la UE. Entre sus cometidos está el de evaluar las modificaciones o ampliaciones (“variaciones”) de una autorización de comercialización existente; y considerar las recomendaciones del Comité de Evaluación de Riesgos en Farmacovigilancia (Pharmacovigilance Risk Assessment Committee; PRAC) de la Agencia sobre la seguridad de los medicamentos comercializados y, cuando sea necesario, recomendar a la Comisión Europea cambios en la autorización de comercialización de un medicamento, o su suspensión o retirada del mercado (5).
El Comité de Medicamentos de Uso Humano de la EMA se reúne una vez al mes. La EMA publica las agendas, actas y aspectos más destacados de las reuniones plenarias. En concreto, los “aspectos destacados” (highlights) de la reunión, un resumen detallado de las decisiones adoptadas se incorporan a la web oficial de la EMA el viernes después del correspondiente pleno de la Comisión (mensual, a excepción de agosto, cuya reunión es sustituida por un procedimiento escrito).
Es importante indicar que la decisiones adoptadas por el plenario del CHMP – positivas, negativas o aplazadas para recabar nuevos datos – solo tienen un carácter de “recomendación” y quedan pendientes de la aprobación definitiva por la Comisión Europea, que las inscribe en el “Union Register of medicinal products for human use” y las publicita en su web oficial (6), donde pueden ser consultadas libremente.
También es preciso matizar que las variaciones o extensiones de indicaciones dictaminadas favorablemente no significan necesariamente que se trate de patologías diversas, sino que en ocasiones son especificaciones adicionales (grupos de edad, antecedentes terapéuticos o genéticos, etc.) de una misma indicación. Por eso, el número de extensiones dictaminadas favorablemente (Recommendations on extensions of of therapeutic indication) por el CHMP es mayor que el de indicaciones terapéuticas propiamente dichas (patologías o procedimientos específicos). A título de ejemplo, citamos dos decisiones (recomendaciones) favorables del CHMP relativas a extensiones de indicaciones correspondiente a la reunión del 19-22 de febrero de 2024 (7):
– En la primera variación de los términos de la autorización europea de comercialización de Carvykti (ciltacabtagene autoleucel) a su titular Janssen-Cilag, el CHMP recomendó la aceptación de una ampliación de la indicación previamente autorizada (30-5-2022) para incluir el tratamiento de pacientes adultos con mieloma múltiple en recaída y refractario, quedando la indicación ampliada de Carvykti para el “tratamiento de pacientes adultos con mieloma múltiple en recaída y refractario, que han recibido al menos una terapia previa, incluido un agente inmunomodulador y un inhibidor del proteasoma, que han demostrado progresión de la enfermedad en la última terapia y son refractarios a lenalidomida”. La anterior indicación era: “tratamiento de pacientes adultos con mieloma múltiple en recaída y refractario, que han recibido al menos tres terapias previas, incluido un agente inmunomodulador y un inhibidor del proteasoma y un anticuerpo anti-CD38 y que han demostrado progresión de la enfermedad en la última terapia”.
– Autorización de una nueva indicación previamente no incluida entre las autorizadas para el medicamento Keytruda (pembrolizumab), autorizada en la Unión Europea el 21-7-2015 para su titular Merck, Sharp & Dohme. En este caso, la decisión favorable adoptada por el CHMP consistió en la recomendación de incluir el tratamiento pre y postoperatorio de adultos cuyo carcinoma de pulmón de células no pequeñas se puede extirpar mediante cirugía y tiene un alto riesgo de recurrencia. En concreto, la nueva indicación autorizada es “Keytruda, en combinación con quimioterapia que contiene platino como tratamiento neoadyuvante y luego continuado en monoterapia como tratamiento adyuvante, está indicado para el tratamiento del carcinoma de pulmón de células no pequeñas resecable con alto riesgo de recurrencia en adultos”. Esta nueva indicación viene a sumarse a las otras cinco que tiene aceptadas Keytruda para el carcinoma de pulmón de células no pequeñas (tres en monoterapia y dos en combinación con otros agentes antineoplásicos). En total, Keytruda (pembrolizumab) acumula actualmente (6-4-2024) 27 indicaciones específicas autorizadas en diversos tipos de cáncer, mientras que en su autorización original (21-7-2015) solo incluía una sola: “en monoterapia está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos”.
Aunque frecuentemente las nuevas extensiones de las indicaciones terapéuticas están estrechamente relacionadas con las previamente autorizadas, en ocasiones se trata de enfoques radicalmente nuevos con un gran calado terapéutico.
La búsqueda e investigación de nuevas aplicaciones para fármacos ya aprobados y en uso clínico – e incluso para compuestos que no llegaron en su momento a las fases de investigación clínicas – es denominado habitualmente como “reposicionamiento”. Nuria Campillo y colaboradoras, del Consejo Superior de Investigaciones Científicas (CSIC), estiman que “hasta el 75% de los fármacos conocidos pueden tener nuevos usos terapéuticos y que los medicamentos en uso clínico podrían utilizarse hasta en 20 aplicaciones diferentes de aquellas para las que fueron aprobados originalmente”. Cabe indicar, en este sentido, que el reposicionamiento permite disponer de fármacos con un perfil de seguridad y eficacia ya conocido, lo que supone un importe ahorro de tiempo y de costes de desarrollo, y en ocasiones es la única vía para el desarrollo de terapias para enfermedades raras, bajo la forma de indicaciones “huérfanas” (8).
Como indican estas científicas, aunque actualmente el reposicionamiento de fármacos se acomete de forma sistemática, hay numerosos ejemplos en los que la serendipia ha permitido acceder a importantes nuevos usos de medicamento ya antes conocidos. El caso de la talidomida es un ejemplo paradigmático de esto último, a pesar de la triste memoria dejada durante la década de los 60 del pasado siglo, donde fue responsable graves deformaciones congénitas en recién nacidos tras ser administrada a embarazadas para mitigar las náuseas, conduciendo a su obvia retirada del mercado. Sin embargo el fármaco reapareció en 1998 tras ser autorizado por la FDA de Estados Unidos para el tratamiento de la lepra y posteriormente, desde 2012, también se autorizó su empleo para tratar el mieloma múltiple. Todo ello sin olvidar que la talidomida es un potente teratógeno en humanos, por lo que no debe utilizarse nunca en mujeres embarazadas o en mujeres que puedan quedarse embarazadas, salvo que se cumplan las estrictas condiciones del Programa de Prevención de Embarazo (incluyendo también a pacientes de sexo masculino).
Otro caso también muy conocido es del sildenafilo (Viagra), universalmente conocido por ser el primer tratamiento autorizado para tratar la disfunción eréctil; posteriormente también fue autorizado para la hipertensión pulmonar, abriendo una nueva e importante vía terapéutica de esta grave patología. También la amantadina, originalmente autorizada como antiviral para el tratamiento de los síntomas característicos y profilaxis de la gripe A, posteriormente fue autorizada para su uso en monoterapia o en combinación con otros fármacos para el tratamiento de los síntomas de la enfermedad de Parkinson, tales como rigidez, temblor, hipocinesia y acinesia. Y podrían citarse otros muchos casos más de reposicionamiento radical de medicamentos.
La actual investigación sistemática sobre el reposicionamiento de medicamentos se basa en datos de medicamentos y enfermedades existentes, el enorme crecimiento de datos biológicos, biomédicos y electrónicos relacionados con la salud a gran escala disponibles públicamente, junto con las capacidades informáticas de alto rendimiento. La integración de datos de múltiples fuentes relacionados con medicamentos, enfermedades y cómo estos medicamentos y enfermedades afectan el cuerpo humano es crucial para enriquecer los modelos computacionales de reposicionamiento de fármacos y mejorar su rendimiento y así llevarlos al siguiente nivel. Además, existe un número importante de enfermedades que aún carecen de tratamientos para frenar, detener o revertir su curso, lo que motiva e inspira a investigadores y científicos multidisciplinarios a realizar estudios, especialmente en diferentes cánceres y miles de enfermedades huérfanas y raras. En resumen, el reposicionamiento computacional de medicamentos puede ser de enorme beneficio no solo para descubrir nuevas indicaciones para medicamentos aprobados, sino también para acelerar el proceso de desarrollo de nuevos medicamentos y brindar una segunda oportunidad a los medicamentos retirados y fallidos (9).
3. TENDENCIAS ACTUALES EN LA EXTENSIÓN DE INDICACIONES TERAPÉUTICAS POR LA EMA
Con el fin de examinar cuál es la actividad innovadora actual en el ámbito de las nuevas indicaciones para medicamentos previamente autorizadas en la Unión Europea, hemos procedido a recopilar y analizar los contenidos de todas los resúmenes (highlights) de las reuniones plenarias del Comité de Medicamentos de Uso Humano CHMP) publicados por la EMA entre enero de 2021 (reunión del 25 al 29) y marzo de 2024 (reunión del 18 al 21) que, incluyendo ambas, son 36.
Durante el periodo analizado se hicieron 258 recomendaciones positivas de extensión de indicaciones, para un total de 181 medicamentos procedentes de 74 laboratorios, lo que da un promedio de 7 extensiones por reunión. Asimismo, el medicamento que más extensiones fueron dictaminadas favorablemente fue Keytruda (pembrolizumab, Merck Sharp & Dohme), con 14 en el periodo estudiado, hasta acumular actualmente un total de 27 indicaciones autorizadas; en segundo lugar está Opdivo (nivolumab, Bristol-Myers Squibb), con 9 nuevas extensiones y acumulando un total de 19 (Tabla 1).
Tabla 1. Medicamentos con mayor (>3) número de extensiones de indicaciones aprobadas por el CHMP 2021-2024.
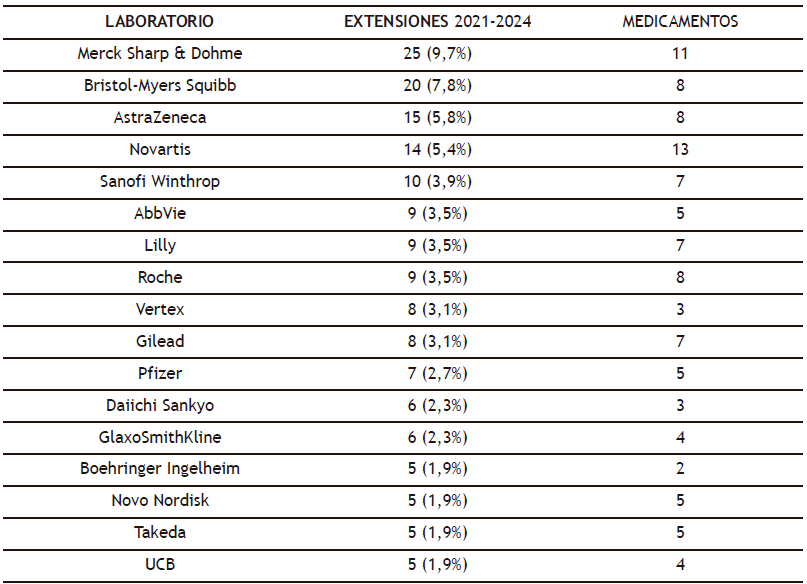
Los laboratorios más activos a la hora de solicitar y recibir una extensión de indicación para algunos de sus medicamentos fueron, con más de 10 extensiones favorablemente recomendadas, Merck Sharp & Dohme (25 para 11 medicamentos; uno solo de ellos recibió 14), Bristol-Myers Squibb (20 para 8 medicamentos; 9 extensiones solo en uno de ellos), AstraZeneca (15 para 8 medicamentos y 3 extensiones en uno de ellos) y Novartis (14 para 13 medicamentos, uno con dos extensiones). Merck Sharp & Dohme acumuló en el periodo analizado el mayor porcentaje (10%) de extensiones recomendadas favorablemente; de hecho, los cinco primeros laboratorios acumularon la tercera parte del total (32,6%) de las nuevas extensiones y la cuarta parte (26%) de los medicamentos para los que fueron aprobadas (Tabla 2).
Tabla 2. Laboratorios titulares de medicamentos con mayor número de extensiones de indicaciones aprobadas por el CHMP (2021-2024)
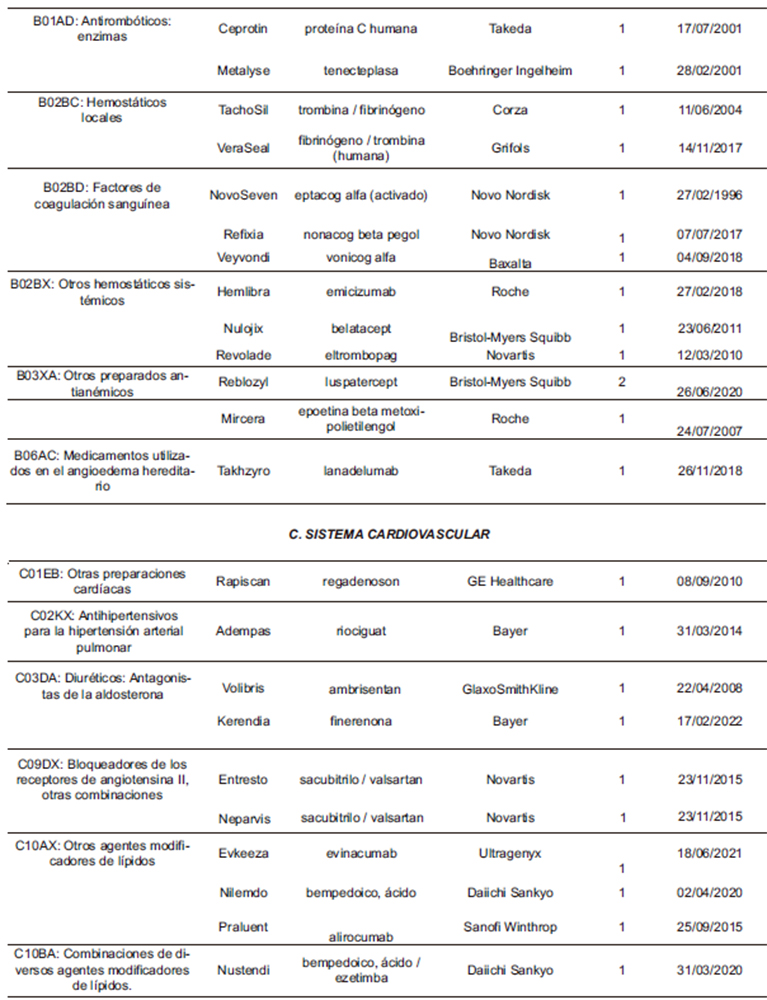
Hasta la fecha del análisis (9/4/2024), el promedio del intervalo transcurrido entre la autorización primaria del medicamento y la aprobación de nuevas extensiones de sus indicaciones durante el periodo analizado es de 6 años; sin embargo, 12 medicamentos extendieron alguna de sus indicaciones menos de un año después de su autorización inicial; tal es el caso de Opfolda (miglustat; autorizado inicialmente en 27/6/2023), Imjudo (tremelimumab; 22/02/23), Mounjaro (tirzepatida; 19/9/2022) y Pepaxti (melfalán; 18/8/2022). Otras extensiones, en cambio, fueron aprobadas más de 20 años tras la autorización inicial del correspondiente medicamento, como NovoSeven (eptacog alfa activado), Iscover y Plavix (clopidogrel), Metalyse (tenecteplasa) y Ceprotin (proteína C humana).
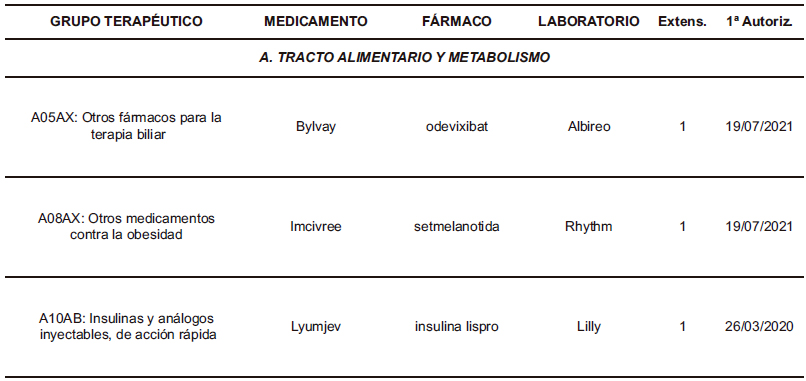
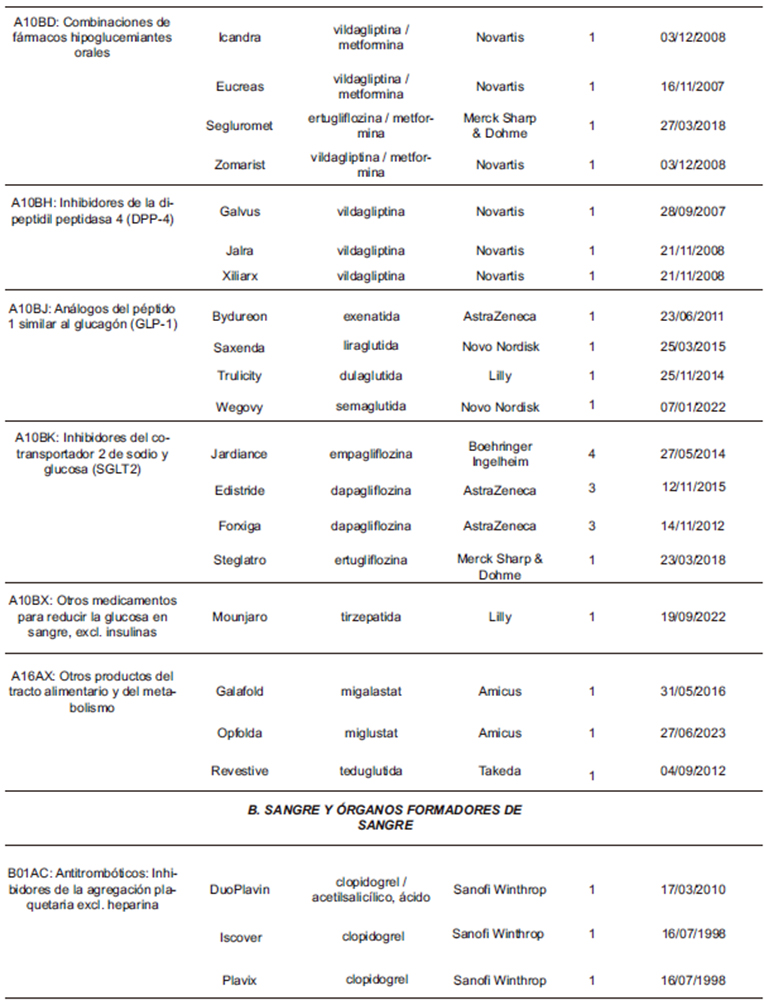
La distribución farmacológica de los medicamentos que extendieron sus indicaciones (Tabla 3) se centra fundamentalmente en los aquellos pertenecientes al grupo de antineoplásicos y agentes inmunomoduladores (L), con 67 medicamentos, lo que supone un 37% de todos los que recibieron la recomendación favorable, con un total de 119 nuevas extensiones, que representan el 46% de todas las aprobadas por el CHMP en el periodo. Es decir, prácticamente la mitad de las nuevas extensiones de indicaciones terapéuticas corresponden a este grupo, lo cual es coherente con las peculiaridades de las propias indicaciones antineoplásicas, sujetas a numerosos y muy diversos condicionantes y antecedentes fisiopatológicos y terapéuticos. Destacan particularmente las 33 nuevas extensiones dictaminadas favorablemente para 6 medicamentos del grupo de anticuerpos monoclonales inhibidores de PD-1/PD-L1 (L01FF).
A continuación le siguen las 43 (17%) extensiones aprobadas de las indicaciones de los 36 (20%) medicamentos del grupo J (Antiinfecciosos de uso sistémico). Destacan las 15 extensiones (para 14 medicamentos) del grupo de antivirales (J05). Por su parte, en el grupo de medicamentos para el tracto alimentario y metabolismo (A) hubo 29 extensiones (11%) que afectaron a 22 medicamentos (12%). Destacan las 11 extensiones (para 4 medicamentos) del grupo de antidiabéticos inhibidores del cotransportador 2 de sodio y glucosa, SGLT2 (A10BK).
Tabla 3. Medicamentos que han recibido alguna extensión de sus indicaciones (2021-2024)
4. REFERENCIAS
- Zaragozá García F, Cuéllar Rodríguez S. Valoración de la innovación terapéutica: importancia y medida. En “Innovación y regulación en biomedicina: obligados a entenderse”; ed. Juan
- Ernesto del Llano Señarís. Fundación Gaspar Casal. ISBN: 978-84-697-2531-3 (2017).
- European Medicines Agency (EMA). Annual Report 2022. https://www.ema.europa.eu/en/annual-report/2022/index.html.
- Food & Drug Administration. New Uses of Approved Drugs 2022. https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/new-drug-therapy-approvals-2022#new-uses
- European Medicines Agency (EMA). Extensions of marketing authorisations: questions and answers. https://www.ema.europa.eu/en/human-regulatory-overview/post-authorisation/variations-including-extensions-marketing-authorisations/extensions-marketing-authorisations-questions-answers.
- European Medicines Agency (EMA). Committee for Medicinal Products for Human Use (CHMP), https://www.ema.europa.eu/en/committees/committee-medicinal-products-human-use-chmp.
- European Comission. Public Health – Union Register of medicinal products. https://ec.europa.eu/health/documents/community-register/html/.
- European Medicines Agency (EMA). Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP) 19-22 February 2024. https://www.ema.europa.eu/en/news/meeting-highlights-committee-medicinal-products-human-use-chmp-19-22-february-2024.
- Campillo Martín NE, Fernández Alonso MC, Jiménez Sarmiento MM. Nuevos usos para viejos medicamentos. Ed. La Catarata / CSIC; ISBN: 9788413522982 (2021)
- Jarada TN, Rokne JG, Alhajj R. A review of computational drug repositioning: strategies, approaches, opportunities, challenges, and directions. J Cheminform. 2020 Jul 22; 12(1): 46. doi: 10.1186/s13321-020-00450-7.