1. INTRODUCCIÓN
Algunos autores mencionan a Darwin y sus estudios de la Pangénesis, donde se citan las “gémulas”, como los precursores de lo que hoy conocemos como material secretado por las células en forma de ácidos nucleicos circulantes, priones y vesículas extracelulares (1). Pero siendo más precisos, los primeros estudios sobre su existencia datarían de 1947, donde se detectaron como “polvo celular” en residuos de plaquetas. Curiosamente, 20 años después también se detectaron estructuras compatibles en plantas (1).
Pero fue en dos artículos científicos publicados en 1983, por los grupos de Phil Stahl de la Washington University en St. Louis, USA y Rose Johnstone en McGill University, en Montreal, Canadá, quienes las describieron en el reciclaje de receptores de transferrina en reticulocitos (2, 3).
El campo de estudio sobre vesículas extracelulares ha evolucionado espectacularmente en los últimos años, encontrándose cerca de 25000 artículos científicos si hacemos una búsqueda bibliográfica utilizando “extracelular vesicles”, y se ha editado la revista científica Journal of Extracellular Vesicles (https://onlinelibrary.wiley.com/journal/20013078), muy reconocida en el campo de la Biología Celular.
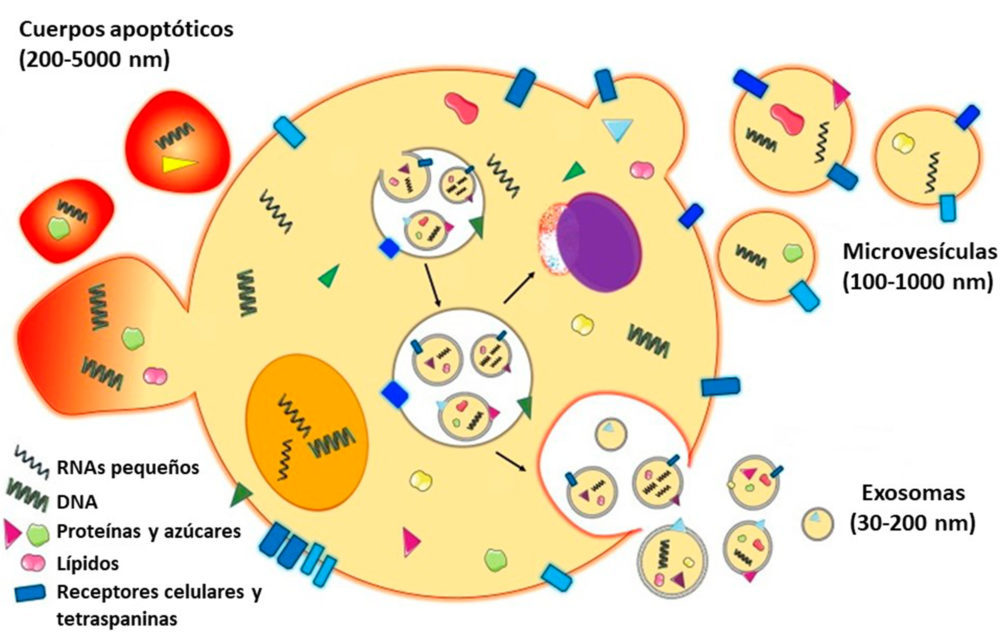
En los últimos años ha existido cierta controversia en cuanto a la nomenclatura a emplear, utilizándose diversos nombres para referirse a dichas vesículas, habiéndose consensuado por parte de la International Society for Extracellular Vesicles (ISEV, https://www.isev.org/), la utilización precisamente del término “vesículas extracelulares” (VEs), que abarcaría a los tres tipos principales, identificados por su tamaño y origen, tal cual son exosomas (las más pequeñas y que se liberan por la fusión de cuerpos multivesiculares con la membrana plasmática), microvesículas (secretadas por gemación a partir de la membrana plasmática) y cuerpos apoptóticos (derivados de la rotura celular) (4) (Figura 1).
Figura 1. Biogénesis de los principales tipos de vesículas extracelulares (Modificada de Drurey et al. (4); Reproducida bajo licencia de Creative Commons)
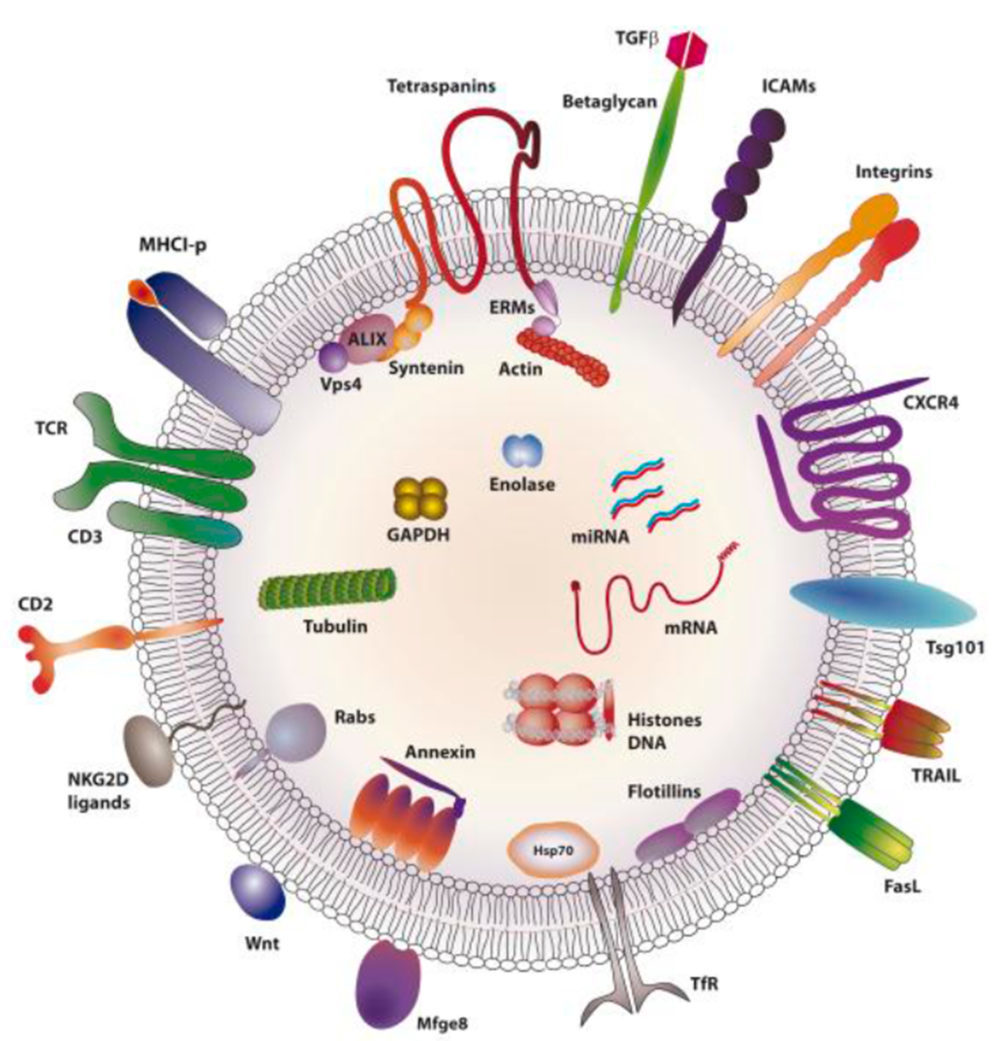
Por lo que se refiere a su composición, utilizaré una imagen publicada en 2013 por el grupo del Dr. Sánchez-Madrid (Académico Correspondiente de la Real Academia Nacional de Farmacia), donde se puede ver que dichas vesículas contienen en su superficie numerosas moléculas incluyendo receptores y tetraspaninas (estas consideradas como marcadores de vesículas), así como fosfolípidos y azúcares. Asimismo, en su interior transportan diverso material que incluye proteínas de origen citosólico (enzimas como enolasa, proteínas del citoesqueleto, de choque térmico, etc.), así como ácidos nucleicos (RNAs, como mRNAs y miRNAs, así como DNA) (5) (Figura 2).
Figura 2. Esquema de la estructura y componentes presentes en vesículas extracelulares (Tomada de Gutiérrez-Vázquez et al., (5); Reproducida con permiso de John Wiley and Sons)
2. VESÍCULAS EXTRACELULARES COMO UN NUEVO PARADIGMA EN LA COMUNICACIÓN INTERCELULAR EN BIOMEDICINA
El envío de dichos componentes protegidos por una membrana lipídica constituye un nuevo paradigma en la comunicación intercelular, que se une a los mecanismos clásicos de comunicación que incluyen el contacto directo entre células o por moléculas mediadoras (i.e. citoquinas, hormonas, etc.).
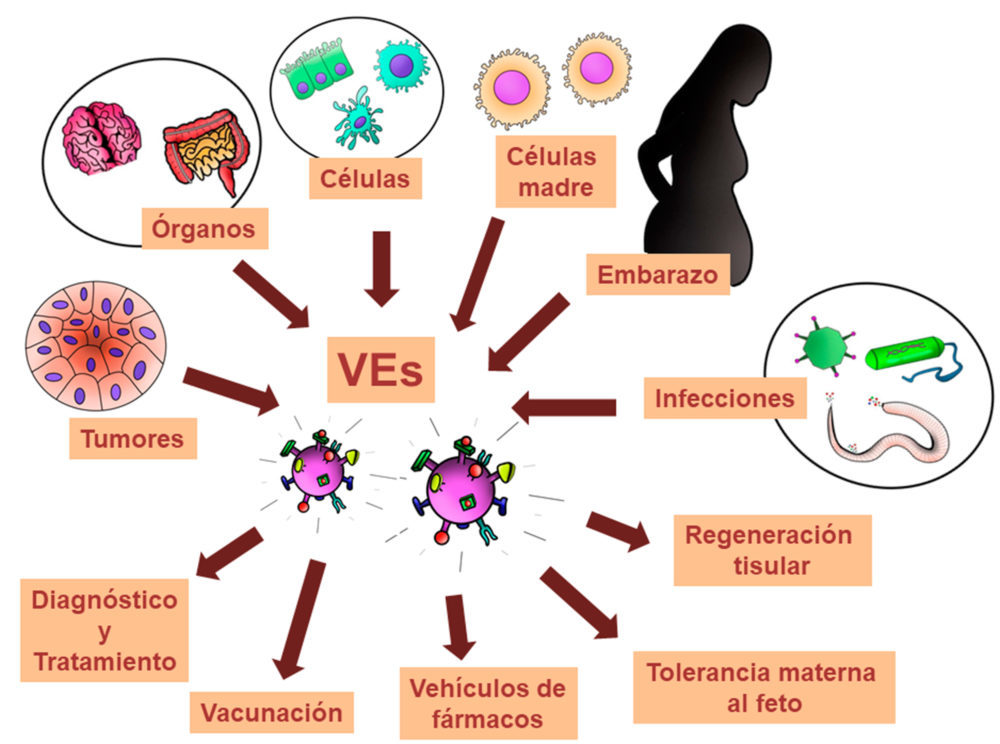
En el congreso del Grupo Español de Investigación e Innovación en Vesículas Extracelulares (GEIVEX, http://www.geivex.org) de 2016 celebrado en Donostia, los Dres. Matías Sáenz y David Otaegui acuñaron el término de “whatsapp celular” para referirse a estas vesículas y su papel en la comunicación, haciendo un analogismo con los sistemas de comunicación que utilizamos los humanos en la actualidad. De hecho, las VEs participan en muy distintos procesos de comunicación en distintos tejidos que incluyen el desarrollo de tumores, la respuesta inmunitaria, o la comunicación madre-feto, y por ello estas vesículas y sus componentes pueden ser utilizadas como biomarcadores en diagnóstico, como dianas de tratamiento o vehículos para el transporte de fármacos, o incluso como sistemas de vacunación (6) (Figura 3).
Figura 3. Aplicaciones biomédicas de vesículas extracelulares. Modificado de Gholizadeh et al. (6)
Dichas VEs pueden promover o atenuar una enfermedad, encontrándose presentes en todos los fluidos biológicos analizados hasta ahora, como se indica en el artículo de revisión dirigido por Dra. Yañez-Mó, y donde tuve el honor de participar junto a numerosos investigadores españoles (7). Dicha publicación, tiene ya (a fecha 8 de mayo de 2021) más de 1200 citas en Pubmed y de 2500 en Google Scholar.
3. UTILIDAD DE LAS VESÍCULAS EXTRACELULARES EN HELMINTOS: UTILIDAD EN EL CONTROL DE ENFERMEDADES
El control de las helmintiasis, infecciones que llevan con los humanos desde su origen, y que son consideradas como “enfermedades desatendidas” (https://www.who.int/teams/control-of-neglected-tropical-diseases/overview) (8), requiere en la actualidad de nuevas herramientas, que permitan tanto un diagnóstico rápido y específico, la posibilidad de generar vacunas, así como la identificación de dianas para nuevos tratamientos (9). Precisamente, en nuestro grupo de investigación del Área de Parasitología en la Universitat de València hemos venido participando en estudios de caracterización de la interacción hospedador-helminto, analizando los materiales que secretan los helmintos (denominados de excreción/secreción). Así, allá por los primeros años de este siglo, y utilizando técnicas de Proteómica pudimos identificar numerosas proteínas citosólicas, denominadas por entonces como “moonlighting proteins”, por su aparente función dual, distinta durante el día- como enzimas glicolíticas-; o “a la luz de la luna”, -como participantes en la interacción con el hospedador. Estas proteínas citosólicas como la piruvato hidratasa, o enolasa, carecen de las señales típicas de rutas de secreción clásicas, como son la presencia de péptido señal o dominios GPI (glicosil fosfatidil inositol). Por tanto, explicar su presencia en productos de excreción/secreción de helmintos era realmente una cuestión no resuelta por entonces, como también ocurría en levaduras o artrópodos, por citar otros organismos.
Y justamente en 2010 cayó en nuestras manos un artículo de revisión sobre caracterización proteómica de exosomas (VEs más pequeñas), de los Dres. Mathivanan y Simpson de Australia, y que resultó altamente inspirador (10). En él se mostraba como muchas de esas moléculas que habíamos identificado mediante técnicas de Proteómica en materiales de excreción/secreción de helmintos, eran secretadas en exosomas en mamíferos. Rápidamente nos pusimos manos a la obra para confirmar si los helmintos secretaban también VEs, adaptando los protocolos previamente descritos para cultivos de células de mamífero al cultivo de adultos de dos trematodos, Echinostoma caproni y Fasciola hepatica (o duela grande del hígado), obtenidos de infecciones experimentales en roedores en el primer caso, y de infecciones naturales (hígados decomisados de mataderos) en el segundo caso.
Tras un proceso de aislamiento mediante procesos de centrifugación diferencial, filtración y ultracentrifugación, las vesículas fueron caracterizadas mediante microscopia electrónica de transmisión, microscopía electrónica de barrido y mediante técnicas de Proteómica. Dichos estudios confirmaron la presencia de dichas vesículas secretadas por helmintos, y que las mismas contenían efectivamente proteínas como enolasa. Pudimos, asimismo, comprobar que este mecanismo de secreción mediante VEs es mayoritario en helmintos, ya que más del 50% de las proteínas secretadas lo hacían dentro de estas vesículas. Etiquetamos dichas vesículas con un fluoróforo y comprobamos su incorporación específica a células intestinales de mamífero en cultivo. Dichos resultados fueron publicados finalmente en 2012 (11).
Con posterioridad, nuestro grupo también ha sido pionero en la identificación de RNAs pequeños (microRNAs) en VEs de helmintos, en concreto las secretadas por el trematodo parásito del ganado Dicrocoelium dendriticum (duela pequeña del hígado) (12).
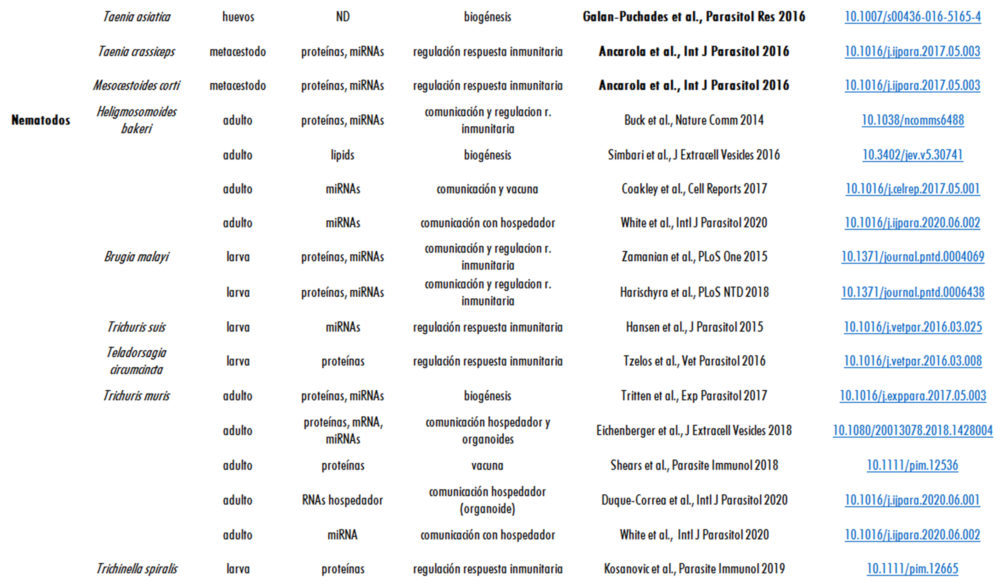
Desde entonces numerosos estudios han descrito VEs en diversos helmintos, tanto trematodos, cestodos como nematodos, utilizando diferentes técnicas de aislamiento e identificando tanto proteínas como microRNAs en los mismos, como se muestra en la Tabla I, constituyendo un campo en continuo crecimiento (Tabla I).
De hecho, dichas vesículas han sido recientemente consideradas como “great balls of wonder”, en un número especial de la revista International Journal for Parasitology gestado a partir de un Seminario Internacional celebrado en la isla griega de Hydra, y parafraseando el título de una canción de 1957 del díscolo Jerry Lee Lewis (13).
Las vesículas extracelulares purificadas a partir de adultos de Fasciola hepatica, y aisladas mediante cromatografía de filtración molecular presentan curiosamente gran diversidad morfológica, apareciendo no solamente redondeadas, sino también como tubos, en formas enrolladas, etc., estructuras que desaparecen al degradar la membrana con un detergente (14).
El análisis proteómico y la localización de las proteínas en las vesículas extracelulares de Fasciola hepatica, realizada en colaboración con el grupo del Dr. Mark Robinson, en Belfast, UK, muestra una gran similitud con lo que se había descrito en VEs de mamíferos por Mathivanan y colaboradores (10, 15).
3.1. Utilidad Diagnóstica
Los estudios de identificación de los componentes de las vesículas extracelulares en infecciones por helmintos están permitiendo su evaluación para sistemas de diagnóstico. En este contexto, se han identificado biomarcadores tanto para infecciones por trematodos y cestodos, ya sea tanto a partir de muestras de animales infestados experimentalmente, como a partir de muestras de pacientes. En la mayoría de los estudios se buscan fundamentalmente miRNAs, tanto del helminto como del hospedador (Tabla I).
Con el objetivo de identificar biomarcadores de infección por Fasciola hepatica en ganado bovino, nuestro grupo viene colaborando con investigadores del Instituto de Salud Global de Barcelona (Dr. Del Portillo), de la Universidad de Granada (el también Académico Correspondiente de esta Corporación, el Prof. Osuna) y del ISCIII de Madrid (Dr. Sotillo). Para ello, y tras aislar VEs de plasma de vacas sanas y vacas parasitadas mediante cromatografía de filtración molecular, dichas VEs han sido caracterizadas por citometría de flujo (con anticuerpos frente a tetraspaninas de la superficie), se han cuantificado las nanopartículas, y se ha confirmado su aislamiento mediante microscopia electrónica de transmisión. Resultados preliminares de caracterización mediante técnicas de proteómica parece indicar que existen diferencias en cuanto a las proteínas presentes en ambos tipos de muestras, lo que nos debiera conducir a la identificación de posibles biomarcadores de la infección (Tabla I).
Tabla I. Helmintos parásitos donde se han descrito vesículas extracelulares, indicando su origen, composición y posible utilidad en Biomedicina.
ND: no determinado. ªEn negrita se muestran las publicaciones donde ha participado el autor
3.2. Utilidad Vacunal
Por lo que respecta a la evaluación de las VEs como agentes vacunales para prevenir la enfermedad, también aquí nuestro grupo de investigación, con las profesoras Dolores Bernal y María Trelis, y la colaboración del Prof. Rafael Toledo, ha sido pionero en el estudio del uso de VEs de helmintos en vacunación. Se evaluó dicho potencial utilizando un modelo experimental de parasitación con Echinostoma caproni en ratón. Los animales fueron inoculados subcutáneamente con VEs purificadas a partir de cultivos del parasito, y posteriormente retados vía oral con metacercarias del parásito para generar la infección experimental. Los resultados mostraron que dicha inmunización no prevenía la infección posterior, pero al menos el desarrollo de la parasitación era más benévolo, con una mayor longevidad de los animales vacunados, frente al grupo control no inmunizado. Asimismo, los vermes obtenidos de dicho grupo inmunizado mostraron menor desarrollo y menor fertilidad (16). Más recientemente, otros grupos han descrito el uso de VEs de helmintos en vacunación (Tabla I), y se ha publicado una revisión sobre el tema (4).
3.3. Utilidad En El Tratamiento De Enfermedades Autoinmunes
Finalmente, dichas VEs se han utilizado recientemente para modular la respuesta inmunitaria, abriendo la posibilidad de su uso como agente terapéutico en enfermedades autoinmunes. Los estudios pioneros de la Dra. Buck, de Edimburgo, UK, demostraron que las VEs producidas por el nematodo intestinal de roedores Heligmosomoides polygyrus podrían modular la respuesta inmunitaria en un modelo experimental de alergia, mejorando la respuesta frente alérgenos del polvo (17).
Ese mismo año nosotros habíamos pronosticado que las VEs podrían modular la respuesta inmunitaria en enfermedades autoinmunes (18), y nos planteamos la siguiente pregunta:
¿Podrían VEs de Fasciola hepatica modular la respuesta inmunitaria en enfermedades autoinmunes (p.e. colitis ulcerosa) sin los inconvenientes de una infestación (terapia helmintiana)?
Para contestar esa pregunta, y en colaboración con investigadores de la Universitat de València, liderados por el Dr. Monteagudo, del Departamento de Patología, y las Dras. Recio y Giner, del Departamento de Farmacología, así como con la colaboración del grupo liderado por el Dr. Sánchez Madrid, del Centro Nacional de Investigaciones Cardiovasculares, llevamos a cabo unos ensayos donde administramos subcutáneamente VEs de Fasciola hepatica, y después producíamos un proceso de colitis ulcerosa aguda en un modelo de ratón mediante la administración por vía oral del agente químico sulfato sódico de dextrano (DSS). Lo que pudimos observar es que la inmunización previa con las VEs hacía disminuir drásticamente los efectos del dextrano, reduciéndose la ulceración intestinal y el sangrado rectal en dichos ratones, donde se recuperaba la integridad de la mucosa. Demostramos, asimismo, que dicho efecto no se debía a la estimulación de linfocitos T maduros, como pudimos comprobar al realizar idénticos ensayos en ratones deficientes para el gen RAG1, los cuales carecen de los mismos (19). Resultados similares han sido también descritos por otros grupos de investigación, utilizando VEs de nematodos como Ancylostoma y Trichinella, lo que apoya nuestros resultados (20, 21).
4. PERSPECTIVAS FUTURAS
Como hemos visto, las vesículas extracelulares de helmintos pueden tener utilidad no solo para controlar helmintiasis, sino también para el control de procesos autoinmunes. La posible utilización de las VEs y sus componentes a nivel biomédico, tanto a nivel veterinario como clínico, requerirá de ensayos de validación y estandarización, que permitan poder escalar, mediante técnicas relativamente sencillas y reproducibles, la producción de moléculas discretas (¿proteínas, miRNAs?) para su uso. Ello además requerirá finalmente cumplir los requerimientos de las agencias reguladoras, como la Agencia Europea del Medicamento (EMA) o la Agencia Española del Medicamento y Productos Sanitarios (AEMPS). El camino no será ni fácil ni corto, pero “caminando se hace camino”, y en nuestro caso siempre en compañía.
5. CONCLUSIONES
En los últimos años hemos vivido un gran auge en el estudio de las vesículas extracelulares de numerosos seres vivos, habiéndose descrito su papel no solo como material de desecho sino como mediadores en la comunicación entre células y organismos, incluso de reinos diferentes. Su identificación y caracterización en helmintos ha permitido resolver algunas cuestiones no resueltas hasta entonces, como era la presencia de moléculas de origen citosólico en la superficie, así como en los materiales secretados y excretados por los mismos. Asimismo, se ha podido confirmar esta vía de secreción como una de las principales en helmintos.
El estudio de las vesículas extracelulares de helmintos además de promover el conocimiento sobre las mismas a nivel de ciencia básica, ha permitido la identificación de biomarcadores que pueden ser de utilidad en ciencia aplicada, como es el control de helmintiasis, por cuanto facilitarían el diagnóstico y la prevención de la enfermedad. Asimismo, dichos estudios están generando nuevas dianas de tratamiento e incluso nuevas posibilidades de tratamiento, no solo de helmintiasis, sino también de enfermedades de tipo autoinmune. Futuros ensayos debieran validar dichos resultados permitiendo la estandarización de protocolos de producción de moléculas discretas con posible potencial clínico.
Agradecimientos
Mi sincero agradecimiento a los miembros de la Real Academia Nacional de Farmacia por el honor que me hacen con este nombramiento y por su cariñosa acogida.
Mi más sentido agradecimiento a las personas e instituciones que me han apoyado a lo largo de mi vida:
En primer lugar, al Sistema Educativo Público y de Calidad, sin cuyas ayudas y becas un joven de una ciudad pequeña de España con inquietudes científicas no hubiera podido realizar su sueño.
Por orden cronológico quiero agradecer a las personas que hicieron nacer en mí la curiosidad científica y que me enseñaron el camino, y a quienes considero mis referentes. A mis queridos profesores, tanto de secundaria como José Antonio Almendros, como de universidad, los profesores Enrique Herrero y Rafael Sentandreu. Este último Académico de Número de esta institución, quien me animó a presentar mi candidatura a Académico Correspondiente, y quien ha realizado un cariñosa presentación de mi trayectoria durante el acto de toma de posesión. Todos ellos me abrieron la mente hacia la investigación. A la Dra. María Victoria Elorza, “Toyi”, con quien inicié mi tarea investigadora, su ejemplo de tesón y perseverancia todavía me siguen inspirando. Gracias a mis compañeros de tesis doctoral en el Departamento de Microbiología de la Facultad de Farmacia de la Universitat de València, quienes siempre han sido siempre un estímulo. Gracias a los compañeros de estancia postdoctoral en Estados Unidos, a los compañeros del Área de Parasitología de la Universitat de València, con el Profesor Santiago Mas-Coma a la cabeza, que me abrieron nuevos campos de investigación.
Gracias especiales a referentes científicos que me han ido acompañando en lo laboral y en lo personal durante estos años, Dres. Pascual Sanz, Eulogio Valentín, Lucas Del Castillo y Pedro Pérez-Bermúdez. Gracias a mis compañeros de la Unidad Mixta de investigación en el IIS La Fe, liderados por los Dres. Francisco Merino y José Miguel Soriano. Gracias a mis compañeros y amigos de la Facultat de Farmàcia de la Universitat de València.
Muchas gracias especialmente a mis queridos compañeros del grupo de investigación ParaSalut, profesores y estudiantes de doctorado, que me han hecho y hacen muy fácil el trabajo diario, compartiendo y enseñándome al mismo tiempo.
Y dejo para el final el inmenso agradecimiento a mis familias en plural: la de origen, la familia de Albacete, un recuerdo especial a mis padres, Antonio y María Josefa, quienes desde su humilde condición me enseñaron el valor del esfuerzo y la constancia; y a mis hermanos, que siempre me ayudaron y confiaron en mí.
A mi segunda familia, los amigos, personas que aun estando geográficamente lejos, siempre han estado cerca, en mi caso desde la infancia y la adolescencia.
Y finalmente, la tercera familia. Mi eterno agradecimiento a mi familia Valenciana, mis padres adoptivos Matilde y Pepe, siempre dispuestos a hacernos la vida más fácil. A mis hijos Jordi, Pau y Xavier, quienes han sufrido muchas de mis ausencias. Y gracias especialmente a Mati, mi compañera de vida, sin cuyo constante estímulo, apoyo y buen hacer, nada hubiese sido posible.
Concluyo con un viejo proverbio africano anónimo, que hago mío en esta ocasión, y que reza así: “Si quieres llegar rápido viaja solo, si quieres llegar lejos ve acompañado”. Muchas gracias.
6. REFERENCIAS
- Liu Y. In search of Darwin’s imaginary Gemmules. Adv Genet. 2018;101:87-114. doi: 10.1016/bs.adgen.2018.05.004. Epub 2018 Jul 17. PMID: 30037394.
- Harding C, Heuser J, Stahl P. Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes. J Cell Biol. 1983 Aug;97(2):329-39. doi: 10.1083/jcb.97.2.329. PMID: 6309857; PMCID: PMC2112509.
- Pan BT, Johnstone RM. Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro: selective externalization of the receptor. Cell. 1983 Jul;33(3):967-78. doi: 10.1016/0092-8674(83)90040-5. PMID: 6307529.
- Drurey C, Coakley G, Maizels RM. Extracellular vesicles: new targets for vaccines against helminth parasites. Int J Parasitol. 2020 Aug;50(9):623-633. doi: 10.1016/j.ijpara.2020.04.011. Epub 2020 Jul 11. PMID: 32659278.
- Gutiérrez-Vázquez C, Villarroya-Beltri C, Mittelbrunn M, Sánchez-Madrid F. Transfer of extracellular vesicles during immune cell-cell interactions. Immunol Rev. 2013 Jan;251(1):125-42. doi: 10.1111/imr.12013. PMID: 23278745; PMCID: PMC3740495.
- Gholizadeh S, Shehata Draz M, Zarghooni M, Sanati-Nezhad A, Ghavami S, Shafiee H, Akbari M. Microfluidic approaches for isolation, detection, and characterization of extracellular vesicles: Current status and future directions. Biosens Bioelectron. 2017 May 15;91:588-605. doi: 10.1016/j.bios.2016.12.062. Epub 2016 Dec 30. PMID: 28088752; PMCID: PMC5323331.
- Yáñez-Mó M, Siljander PR, Andreu Z, Zavec AB, Borràs FE, Buzas EI, Buzas K, Casal E, Cappello F, Carvalho J, Colás E, Cordeiro-da Silva A, Fais S, Falcon-Perez JM, Ghobrial IM, Giebel B, Gimona M, Graner M, Gursel I, Gursel M, Heegaard NH, Hendrix A, Kierulf P, Kokubun K, Kosanovic M, Kralj-Iglic V, Krämer-Albers EM, Laitinen S, Lässer C, Lener T, Ligeti E, Linē A, Lipps G, Llorente A, Lötvall J, Manček-Keber M, Marcilla A, Mittelbrunn M, Nazarenko I, Nolte-‘t Hoen EN, Nyman TA, O’Driscoll L, Olivan M, Oliveira C, Pállinger É, Del Portillo HA, Reventós J, Rigau M, Rohde E, Sammar M, Sánchez-Madrid F, Santarém N, Schallmoser K, Ostenfeld MS, Stoorvogel W, Stukelj R, Van der Grein SG, Vasconcelos MH, Wauben MH, De Wever O. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 2015 May 14;4:27066. doi: 10.3402/jev.v4.27066. PMID: 25979354; PMCID: PMC4433489.
- Hotez PJ, Brindley PJ, Bethony JM, King CH, Pearce EJ, Jacobson J. Helminth infections: the great neglected tropical diseases. J Clin Invest. 2008 Apr;118(4):1311-21. doi: 10.1172/JCI34261. PMID: 18382743; PMCID: PMC2276811.
- Hotez PJ, Pecoul B, Rijal S, Boehme C, Aksoy S, Malecela M, Tapia-Conyer R, Reeder JC. Eliminating the Neglected Tropical Diseases: Translational Science and New Technologies. PLoS Negl Trop Dis. 2016 Mar 2;10(3):e0003895. doi: 10.1371/journal.pntd.0003895. PMID: 26934395; PMCID: PMC4774924.
- Mathivanan S, Ji H, Simpson RJ. Exosomes: extracellular organelles important in intercellular communication. J Proteomics. 2010 Sep 10;73(10):1907-20. doi: 10.1016/j.jprot.2010.06.006. Epub 2010 Jul 1. PMID: 20601276.
- Marcilla A, Trelis M, Cortés A, Sotillo J, Cantalapiedra F, Minguez MT, Valero ML, Sánchez del Pino MM, Muñoz-Antoli C, Toledo R, Bernal D. Extracellular vesicles from parasitic helminths contain specific excretory/secretory proteins and are internalized in intestinal host cells. PLoS One. 2012;7(9):e45974. doi: 10.1371/journal.pone.0045974. Epub 2012 Sep 24. PMID: 23029346; PMCID: PMC3454434.
- Bernal D, Trelis M, Montaner S, Cantalapiedra F, Galiano A, Hackenberg M, Marcilla A. Surface analysis of Dicrocoelium dendriticum. The molecular characterization of exosomes reveals the presence of miRNAs. J Proteomics. 2014 Jun 13;105:232-41. doi: 10.1016/j.jprot.2014.02.012. Epub 2014 Feb 21. PMID: 24561797.
- Hoffmann KF, Hokke CH, Loukas A, Buck AH. Helminth extracellular vesicles: great balls of wonder. Int J Parasitol. 2020 Aug;50(9):621-622. doi: 10.1016/j.ijpara.2020.07.002. PMID: 32771117.
- Sánchez-López CM, Trelis M, Jara L, Cantalapiedra F, Marcilla A, Bernal D. Diversity of extracellular vesicles from different developmental stages of Fasciola hepatica. Int J Parasitol. 2020 Aug;50(9):663-669. doi: 10.1016/j.ijpara.2020.03.011. Epub 2020 Jun 10. PMID: 32531305.
- Cwiklinski K, de la Torre-Escudero E, Trelis M, Bernal D, Dufresne PJ, Brennan GP, O’Neill S, Tort J, Paterson S, Marcilla A, Dalton JP, Robinson MW. The Extracellular Vesicles of the Helminth Pathogen, Fasciola hepatica: Biogenesis Pathways and Cargo Molecules Involved in Parasite Pathogenesis. Mol Cell Proteomics. 2015 Dec;14(12):3258-73. doi: 10.1074/mcp.M115.053934. Epub 2015 Oct 20. PMID: 26486420; PMCID: PMC4762619.
- Trelis M, Galiano A, Bolado A, Toledo R, Marcilla A, Bernal D. Subcutaneous injection of exosomes reduces symptom severity and mortality induced by Echinostoma caproni infection in BALB/c mice. Int J Parasitol. 2016 Nov;46(12):799-808. doi: 10.1016/j.ijpara.2016.07.003. Epub 2016 Aug 30. PMID: 27590846.
- Buck AH, Coakley G, Simbari F, McSorley HJ, Quintana JF, Le Bihan T, Kumar S, Abreu-Goodger C, Lear M, Harcus Y, Ceroni A, Babayan SA, Blaxter M, Ivens A, Maizels RM. Exosomes secreted by nematode parasites transfer small RNAs to mammalian cells and modulate innate immunity. Nat Commun. 2014 Nov 25;5:5488. doi: 10.1038/ncomms6488. Erratum in: Nat Commun. 2015;6:8772. PMID: 25421927; PMCID: PMC4263141.
- Montaner S, Galiano A, Trelis M, Martin-Jaular L, Del Portillo HA, Bernal D, Marcilla A. The role of extracellular vesicles in modulating the host immune response during parasitic infections. Front Immunol. 2014 Sep 8;5:433. doi: 10.3389/fimmu.2014.00433. PMID: 25250031; PMCID: PMC4157553.
- Roig J, Saiz ML, Galiano A, Trelis M, Cantalapiedra F, Monteagudo C, Giner E, Giner RM, Recio MC, Bernal D, Sánchez-Madrid F, Marcilla A. Extracellular vesicles from the helminth Fasciola hepatica prevent DSS-induced acute ulcerative colitis in a T-lymphocyte independent mode. Front Microbiol. 2018 May 23;9:1036. doi: 10.3389/fmicb.2018.01036. PMID: 29875750; PMCID: PMC5974114.
- Eichenberger RM, Ryan S, Jones L, Buitrago G, Polster R, Montes de Oca M, Zuvelek J, Giacomin PR, Dent LA, Engwerda CR, Field MA, Sotillo J, Loukas A. Hookworm secreted extracellular vesicles interact with host cells and prevent inducible colitis in mice. Front Immunol. 2018 Apr 30;9:850. doi: 10.3389/fimmu.2018.00850. PMID: 29760697; PMCID: PMC5936971.
- Gao X, Yang Y, Liu X, Wang Y, Yang Y, Boireau P, Liu M, Bai X. Extracellular vesicles derived from Trichinella spiralis prevent colitis by inhibiting M1 macrophage polarization. Acta Trop. 2021 Jan;213:105761. doi: 10.1016/j.actatropica.2020.105761. Epub 2020 Nov 19. PMID: 33221281.