RESUMEN:
Este artículo resume la información científica sobre las características de los virus SARS-CoV-2, incluyendo el fundamento y las dificultades a las que se enfrenta la búsqueda de su correcto y rápido diagnóstico, su tratamiento, y una prevención eficaz.
Palabras Clave: SARS-CoV-2; diagnóstico; tratamiento; prevención.
ABSTRACT:
This article summarizes the scientific information about the characteristics of SARSCoV-2, including the basis and difficulties that is facing the search for its correct and fast diagnosis and efficient procedures for its treatment and prevention.
Keywords: SARS-CoV-2; diagnosis; treatment; prevention.
1. INTRODUCCIÓN
En los momentos actuales, en que medio mundo está paralizado experimentando una situación de catástrofe desconocida hasta ahora, no podríamos titular estas líneas como he venido haciendo esporádicamente en nuestra revista Anales RANF: “Comentarios a una noticia”, sino “Comentarios a una avalancha de noticias”. Los datos acerca de la evolución del virus SARS-CoV-2 desde el punto de vista humano, social y económico son terroríficos y obligan a buscar esperanza buceando en la información que nos proporcionan las ciencias biomédicas para comprender la situación de la mejor manera posible. Estos días he intentado satisfacer mi curiosidad de ese modo, y ahora me atrevo a compartir esta información con ustedes a través de esta breve reseña, una más de las que nos llegan a través de los medios que demuestra a mi entender el poder terapéutico de la escritura en los periodos de confinamiento.
En primer lugar debo advertirles que, para facilitar su reconocimiento en gran parte de la literatura científica, se utilizan aquí las siglas en inglés y que, para aligerar este texto, se ha prescindido de representaciones gráficas. Tampoco se van a mencionar teorías conspiratorias, ni participar en el debate sobre cuales son las mejores estrategias para combatir a SARS-CoV-2, o los comentarios críticos sobre la gestión de la epidemia en España y en el mundo. Solo intentamos comentar someramente lo que nos dice la comunidad científica que, al igual que ocurrió en el comienzo del último brote del virus Ébola, se ha volcado para intentar superar este nuevo desafío.
2. QUÉ SON Y CÓMO ACTÚAN LOS VIRUS SARS-COV-2
Como es sabido, los virus son partículas compuestas por proteínas, material genético y, según el tipo de virus, una membrana llamada envuelta o cápside. Los miembros de la familia de los coronavirus, a la que pertenece SARS-CoV-2, pueden tener además una membrana que envuelve a la cubierta y está rodeada de espículas a modo de corona que el virus utiliza para reconocer y penetrar en las células humanas o de animales hospedadores a través del dominio de unión a un receptor (RBD) de las proteínas S que las recubren. Este dominio es el mejor candidato a antígeno que puede utilizarse para inducir protección a través de una futura vacuna. La denominación de proteínas S proviene de la palabra spike, espícula en inglés. Estas proteínas poseen dos subunidades: S1 y S2; la primera está implicada en el reconocimiento del receptor celular y la segunda participa en la fusión entre las membranas celulares y virales (1).
Es muy importante recordar que las partículas víricas no son seres vivos, no comen ni se mueven por sí solas. Tampoco pueden multiplicarse, y se encuentran flotando en el aire o depositadas en superficies hasta su desintegración. Un virus se reproduce cuando logra infectar una célula viva, en la que penetra porque ésta posee receptores que reconocen determinadas proteínas de la envuelta del virus (de las espículas si son coronavirus). Una vez dentro de la célula liberan su contenido, y aprovechan los recursos y la maquinaria de ésta para multiplicarse con mucha eficiencia. En esta fase aparecen los síntomas de la enfermedad, que en el caso de SARS-CoV-2 afectan al sistema respiratorio y pueden generar una neumonía más o menos grave, denominada COVID-19, que puede resultar mortal.
Antes del año 2003, los coronavirus solo se conocían como causantes del resfriado común en humanos. La primera epidemia mortal conocida causada por ellos fue el síndrome respiratorio agudo (SARS), que surgió en el sudeste de China a principios del año 2003. Este brote afectó a 29 países, pero ocho meses después de que comen- zara a manifestarse estaba contenido con medidas tradicionales de salud pública, y actualmente se considera extinguido.
En 2012 se identificó en Arabia Saudí el coronavirus MERS-CoV, causante del Síndrome Respiratotio de Oriente Medio (MERS), que causó 858 muertes, la mayoría en Arabia Saudí. SARS y MERS-CoV parecen haber tenido su origen lejano en los murciélagos, ya que en ellos se detectan coronavirus muy semejantes. En el caso de MERS-CoV se han identificado a los dromedarios como hospedadores intermediarios entre el murciélago y el hombre. Este virus no se transmite eficientemente de un individuo a otro a menos que el contacto sea muy estrecho y, pasado un tiempo, solo se han detectado algunos casos aislados. Este comportamiento ha hecho pensar a los especialistas que MERS-CoV no está totalmente adaptado para propagarse y, a día de hoy, no parece que represente una amenaza pandémica. Sin embargo, no debe olvidarse que los virus cuyo material genético es RNA tienen una gran capacidad para generar mutantes que se adaptan rápida- mente a las diferentes presiones de selección. Por eso, se piensa que MERS-CoV ha logrado replicarse desde su hospedador inicial, muy probablemente el murciélago, en organismos diferentes como son los dromedarios y los seres humanos, pero podría necesitar algún tiempo para lograr perfeccionar su transmisión entre estos últimos (2).
El 31 de diciembre de 2019, China comunicó a la OMS el brote de una nueva cepa causante de una neumonía grave, a la que se denominó COVID-19. El coronavirus responsable de la misma era una variante hasta entonces desconocida de los virus SARS, a la que se denominó SARS-CoV-2. Los virus del SARS ingresaban en su célula hospedadora uniéndose al receptor de la enzima conversora de angiotensina 2 (ACE-2), implicada en la regulación de la presión sanguínea, y se replicaban en la profundidad de los pulmones, lo que posiblemente contribuyó a una gran tasa de mortalidad, pero también a una propagación menos probable porque el contagio se producía cuando una persona estaba muy enferma.
Por su parte, MERS-CoV ingresa en sus células hospedadoras uniéndose al receptor de dipeptidil peptidasa-4 (DPP-4). La enzima DPP-4, también llamada grupo de diferenciación 26 (CD26), se expresa en la membrana de distintos tipos de células y se asocia con la regulación de la respuesta inmune, la transducción de señales, y la apoptosis (3).
Finalmente, el coronavirus SARS-CoV-2 también entra en las células hospedadoras por los receptores ACE-2, pero se multiplica en la nariz y las vías respiratorias superiores, como la gripe, por lo que se puede transmitir más fácilmente a través de la tos y los estornudos en una fase inicial de la enfermedad, siendo más difícil identificar y aislar a los enfermos antes de que infecten a otros. Puede afirmarse que la menor tasa de mortalidad de los virus SARS-CoV-2 en comparación con la del SARS es un alivio desde el punto de vista médico, pero obstaculiza su prevención.
Los estudios epidemiológicos iniciales practicados en China en pacientes hospitalizados con COVID-19, indicaron que la hipertensión arterial y la diabetes podían estar asociadas a un mayor riesgo de mortalidad, motivando la hipótesis en que los efectos adversos de los inhibidores de la enzima convertidora de angiotensina (ACEI) y los antagonistas o bloqueantes de los receptores de la angiotensina 2 (ARA-II) tienen relación con esta evolución, ya que estos fármacos y algunos antidiabéticos pueden inducir la sobreexpresión de receptores ACE-2 como efecto secundario indeseable. Si esto fuera así, bastaría con modificar los tratamientos de estas dos enfermedades utilizando fármacos que posean otros mecanismos de acción y no sobreexpresen este receptor. Sin embargo, la Sociedad Española de Medicina de Familia y Comunitaria (Semfyc) ha manifestado que, de momento, la evidencia científica de esta relación no está demostrada, ya que los estudios epidemiológicos deben acompañarse con estudios de causalidad.
Al poco tiempo de su descubrimiento, los científicos chinos habían secuenciado el genoma de SARS-CoV-2, que posee cerca de 30.000 nucleótidos, y habían analizado el patrón genético de las proteínas de sus espículas. Estos datos se pusieron a disposición de todo el mundo, pero al parecer, éste no fue consciente de la magnitud del problema que se le venía encima, ya que este virus, aunque parece ser menos letal que SARS, tiene una tasa de contagio mucho mayor, y su rápida expansión puede llegar a colapsar los sistemas sanitarios provocando una mayor mortalidad. Actualmente, más de 600 secuencias de estirpes del virus SARS-CoV-2, aisladas y secuencias en todo el mundo, están en bases de datos de público acceso
Las proteínas de espiga de SARS y de SARS-CoV-2 podrían haber evolucionado en el murciélago para enlazarse eficazmente al receptor de ACE2 y ser patógenas, aunque también es posible que el salto del animal al hombre lo realizara una versión no patógena, y la evolución a patógena se hubiera realizado en células humanas. Como el material genético de SARS-CoV-2 que vierte el virus en el citoplasma de las células infectadas es RNA monocatenario, su estabilidad es menor que la de la más robusta doble hélice de un virus DNA y, en consecuencia, su capacidad de mutación es mayor. También es mayor la posibilidad de que la inmunidad adquirida de forma natural o por el uso de vacunas frente a esta cepa no sea útil en la siguiente oleada vírica (4). Esta es una circunstancia importante, porque si se deja que se infecte una gran parte de la población para proteger a los individuos en un próximo brote, no puede asegurarse la duración de la inmunidad lograda. Esta advertencia, ha sido una de las bases del informe realizado por el Imperial College y la Escuela de Higiene y Medicina Tropical de Londres para que Gran Bretaña cambiara la estrategia que había iniciado y se implantaran las políticas de confinamiento a pesar de la enorme repercusión económica de éstas.
3. DIAGNÓSTICO
Las infecciones respiratorias agudas, como son las neumonías causadas por patógenos bacterianos o víricos, requieren un diagnóstico de urgencia rápido y fiable para evitar un tratamiento antibiótico in- adecuado y una posible propagación de la infección. La identificación de los agentes infecciosos utilizando los métodos de cultivo convencionales son largos, y en ocasiones no concluyentes debido a que el cultivo de algunos virus puede tener dificultades o no puede realizarse. Por eso, en numerosas enfermedades infecciosas se han complementado o sustituido los métodos clásicos de detección, como los cultivos y los inmunoensayos, por métodos de detección molecular como la reacción en cadena de la polimerasa (PCR) en tiempo real. Estos procedimientos han revolucionado el diagnóstico médico y, en la actualidad, son una parte esencial en un laboratorio de diagnóstico.
La técnica PCR, que permite copiar y multiplicar un trozo de DNA específicamente seleccionado, ha resultado vital en la investigación y tecnología del DNA. Fue descubierta en 1983 por el bioquímico estadounidense Kary Banks Mullis, que recibió por este motivo el Pre- mio Nobel de Química de 1993 compartido con Michael Smith. La de- tección de enfermedades hereditarias o la determinación de la paternidad son algunas de sus aplicaciones más populares. En el caso de COVID-19, la carga vírica se determina amplificando los genes presentes en una muestra del paciente, lo que puede hacerse desde me- diados de enero tras la publicación del código genético del parásito. Para SARS-CoV-2 se requiere previamente transformar su RNA en DNA (la transcripción inversa), generando la cadena complementaria. Después del aislamiento del DNA, se amplifican fragmentos del gen diana (amplicones) y se detectan con sondas fluorescentes. La señal de fluorescencia que detecta la unidad óptica del instrumento de PCR aumenta con la cantidad de amplicones formados en tiempo real. Este procedimiento exige disponer de personal formado y de un equipamiento de alto rendimiento para extraer el RNA vírico y analizar centenares de muestras simultáneamente.
Muchos laboratorios anuncian estos días buenos resultados en la detección y determinación de la carga viral de SARS-CoV-2 utilizando nuevas técnicas que minimizan los falsos negativos y se resuelven en un tiempo corto. Por ejemplo, el laboratorio Virvell (una empresa de Biotecnología de Granada), informó en su página web que el kit “Sars-Cov-2 Realtime PCR” es específico para COVID-19 y otros coronavirus relacionados con el SARS, y arroja resultados rápidos y confiables en 90 minutos. Imegen, un laboratorio valenciano especializado en genética y genómica, ha adaptado uno de sus centros para poder realizar 500 pruebas diarias de este coronavirus. La empresa biotecnológica de PharmaMar, denominada “Genómica”, anunció también que había completado con éxito las pruebas realizadas en muestras de pacientes con sus kits de diagnóstico del coronavirus SARS-CoV2, en colaboración con el Instituto de Salud Carlos III. Estos kits, que según la empresa han sido validados por la CE (acreditando el cumplimiento de los requisitos esenciales descritos en la Directiva 98/79/CE sobre productos sanitarios para diagnóstico in vitro), están disponibles comercialmente y son muy sensibles y específicos, por lo que este coronavirus podría detectarse incluso antes de que el paciente muestre síntomas.
A nivel internacional hay igualmente una lucha contrarreloj para incorporar al mercado nuevos kits diagnóstico rápidos y fiables. Roche, por ejemplo, ha desarrollado equipos totalmente automatiza- dos que pueden proporcionar resultados en unas tres horas y han sido aprobados con urgencia por la FDA para su comercialización en EEUU. Dejando aparte el precio de estas pruebas, se ha hecho evidente que las instalaciones médicas y los laboratorios de diagnóstico se saturan, incluso en los países desarrollados, cuando llegan oleadas agudas de una infección y, en esta circunstancias, los tests diagnósticos se limitan a determinados pacientes. Esta actuación se justifica argumentando que cuando no hay síntomas, pueden darse falsos negativos si no hay suficientes virus en la muestra (generalmente recogida de la garganta o de la nariz) para que se obtenga un resultado positivo en una PCR. Otra cuestión que preocupa relacionada con los tests diagnósticos es la probabilidad de que algunos pacientes recuperados siguieran siendo portadores o reinfectarse. A finales de febrero, tras conocerse que algunos pacientes dados de alta en China estaban enfermando de nuevo tras salir del hospital, la prefectura de Osaka en Japón comunicó que una mujer había dado positivo después de cumplir con los criterios de alta. Las personas convalecientes ¿podrían no tener suficientes anticuerpos para desarrollar la inmunidad y se están infectando de nuevo? ¿El virus permanece dormido en el organismo antes de crear nuevos síntomas? Para algunos, estos primeros casos de “reinfección” se pueden atribuir a discrepancias en los tests diagnósticos o a los diferentes protocolos para dar de alta a los enfermos. Aunque la reinfección no es imposible, hay que confiar en que cuando un individuo ha desarrollado una respuesta inmune generando anticuerpos en la primera infección, la segunda infección sea menos grave.
4. TRATAMIENTO
Aunque los más optimistas apuntan a plazos más cortos, se acepta que pasarán unos 1,5 años antes de que se pueda desarrollar una vacuna apropiada, se comprueben sus efectos secundarios en todas las fases del ensayo, se apruebe por las autoridades sanitarias, se produzca en grandes cantidades, y se distribuya a todo el mundo. Por tanto, disponer lo antes posible de un tratamiento antiviral es particularmente importante. Un virus no es un ser vivo y, por tanto, no puede eliminarse con antibióticos. Solo se puede retrasar el contagio y reducir el tiempo de duración y la gravedad de la enfermedad que produce. Hasta ahora, no existen medicamentos contra el nuevo coronavirus SARS-CoV-2 aunque, según la OMS, al menos 35 compañías están buscando un fármaco que pueda neutralizar los efectos de este virus. Para acelerar el proceso, se están ensayando diferentes fármacos o combinaciones de los mismos que han sido aprobados anteriormente para otros usos. En España se ha hablado mucho estos días de aplidina (o plitidepsina), un ciclodepsipéptido aislado de la ascidia Aplidium albicans comercializado como Aplidin® por PharmaMar. Éste se había declarado previamente orphan drug por la FDA y había sido aprobado en algunos países para el tratamiento del mieloma múltiple. La empresa ha comunicado que la aplidina logra detener la reproducción del coronavirus humano HCoV-229E. Hay que comentar que éste es uno de los virus responsables del resfriado común y por tanto se trata de otro virus y que, además, el ensayo inicial no ha pasado todavía de los estudios in vitro. Sin embargo, el virólogo Luis Enjuanes, que dirige junto a Isabel Sola y Sonia Zúñiga el laboratorio de coronavirus del Centro Nacional de Biotecnología (CNB-CSIC) en Madrid, ha comentado en una nota de prensa que se trata de “un resultado prometedor”.
El esfuerzo para reposicionar a muchos fármacos análogos de nucleótidos o inhibidores de proteasa utilizados como antirretrovirales para HIV es ingente. Por ejemplo, la combinación de los inhibidores de proteasa lopinavir y ritonavir, comercializada por Abbvie con el nombre de Kaletra® para el tratamiendo del síndrome de la inmunodeficiencia adquirida (SIDA en español), se ha estudiado en el
Hospital Virgen del Rocío de Sevilla asociada con interferón b. Desafortunadamente, los resultados preliminares de un estudio clínico re- alizado en China con lopinavir/ritonavir en adultos hospitalizados por infección con SARS-CoV-2 en estado grave, se han publicado en New England Journal of Medicine concluyéndose que este tratamiento no ofrece beneficios (5). No obstante, como falta aclarar si estos resultados se deben a que Kaletra® es ineficaz contra el nuevo coronavirus o a que los participantes en el ensayo ya habían desarrollado complica- ciones demasiado graves para beneficiarse de este tratamiento, la OMS lo mantiene entre los tratamientos que se evaluarán los próximos meses en un ensayo clínico internacional.
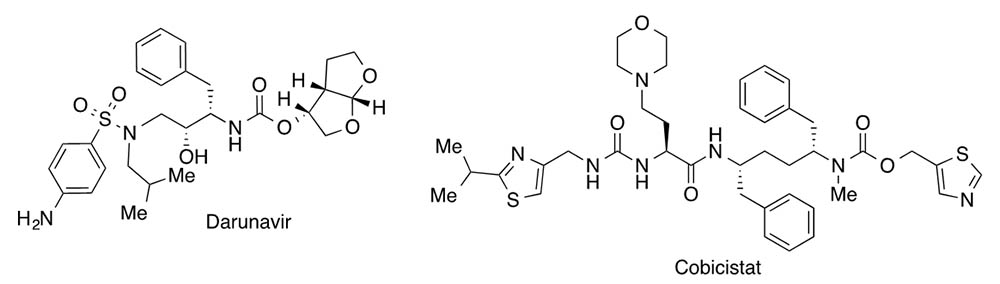
En el Hospital Germans Trias i Pujol de Badalona, se ha iniciado otro ensayo para evitar la transmisión de esta epidemia con una combinación comercializada por la empresa Janssen denominada Rezolsta®, que se utiliza como tratamiento anti HIV. Esta combinación está formada por el inhibidor de proteasa darunavir y el inhibidor suicida del citocromo P450 3A (CYP3A) cobicistat, que retrasa su degradación.
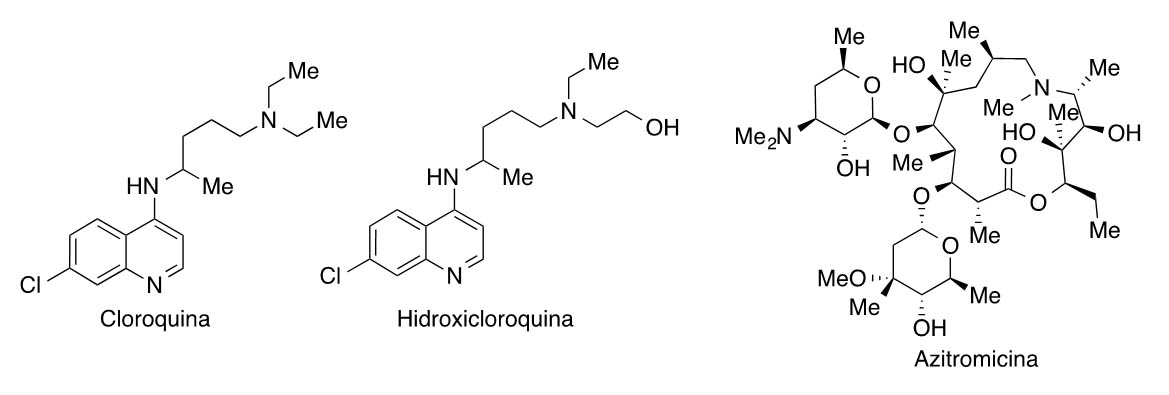
También se están estudiando combinaciones de antivirales (especialmente los activos frente a SARS y MERS) con el antimalárico cloroquina o su análogo menos tóxico hidroxicloroquina, el antibacteriano azitromicina (un antibiótico macrólido de amplio espectro que está incluido en los “protocolos sepsis” para prevenir una sobreinfección bacteriana), o el anticuerpo monoclonal sarilumab (Kevzara®). Estos estudios se basan en estudios in vitro y en un ensayo clínico con pacientes de COVID-19 en el Hospital Universitario de Marsella, que ha corroborado la eficacia de la cloroquina o la hidroxicloroquina para reducir la carga viral, lo que ha despertado mucho interés mediático a pesar del pequeño número de pacientes. A algunos de los enfermos de este ensayo francés se les administró también azitromicina, y esta asociación fue más efectiva que cuando se administró exclusivamente hidroxicloroquina (6).
La cloroquina y la hidroxicloroquina se han utilizado durante años en el tratamiento de la malaria, y también se emplean en ciertas amebiasis, en la artritis reumatoide, y en el lupus. La cloroquina, descubierta en 1934, se encuentra en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud, que incluye a los fármacos más seguros y efectivos que se requieren en un sistema sanitario. Desde el año 2005, se sabía que la cloroquina bloquea la reproducción de SARS-CoV-1 en cultivos celulares. Estos efectos antivirales se han relacionado con un aumento del pH que afecta sobre todo a las infecciones víricas que invaden las células a través de la vía del endosoma, como el virus de la gripe aviar o el virus del Zika entre otros. En este proceso, el material es englobado primero en una depresión endocítica, y los endosomas formados funcionan como transportadores. La disminución del pH cataliza la fusión de las membranas virales y celulares, permitiendo al virus verter su material genético y reproducirse; pero cuando las células se tratan con cloroquina o hidroxicloroquina, el pH del endosoma se eleva, lo que evita esta fusión y bloquea la infección viral. Un estudio realizado por los Centros para el Control y Prevención de Enfermedades de los EEUU encontró que la cloroquina inhibe la replicación del virus al reducir la glicosilación terminal de los receptores de ACE2 e interferir su unión con SARS-CoV-2, un hallazgo interesante. En EEUU se está ensayando la combinación de cloroquina o hidroxi- cloroquina con remdesivir (GS-5734).
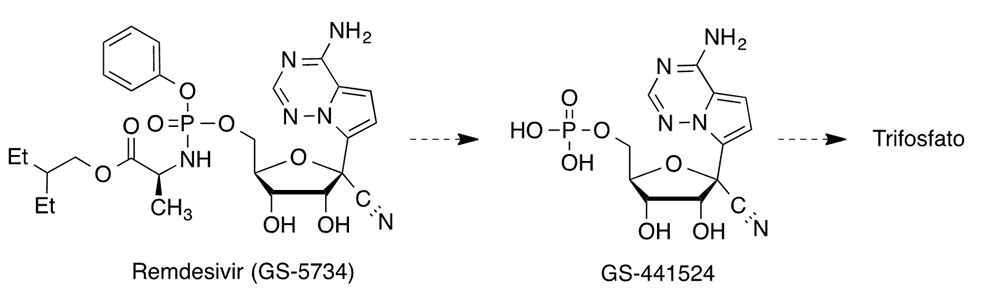
Este fármaco se diseñó originalmente contra el virus Ébola por la empresa Gilead. Esta empresa desarrolló también sofosbuvir (Sovaldi®) contra el virus que origina la hepatitis C y la combinación denominada Truvada®, compuesta por emtricitabina y tenofovir disoproxilo, que es la primera que puede pre- venir el contagio de HIV conocido como profilaxis preexposición. Dado que remdesivir había resultado eficaz contra el virus MERS y otros coronavirus, los médicos solicitaron la autorización de la FDA para usarlo con fines compasivos en COVID-19. Por ahora, parece que remdesivir salvó la vida de una mujer que se encontraba en estado grave en Sacramento, y se están llevando a cabo cinco ensayos clínicos con este fármaco: dos en China, uno en EEUU patrocinado por el Instituto Na- cional de Salud (NIH), y otros dos que están en manos de Gilead y se realizan en distintos países. Al parecer, estos estudios están muy adelantados, aunque existen rumores acerca de las dificultades con que podría encontrarse la comercialización de este compuesto debido a algunos efectos secundarios observados.
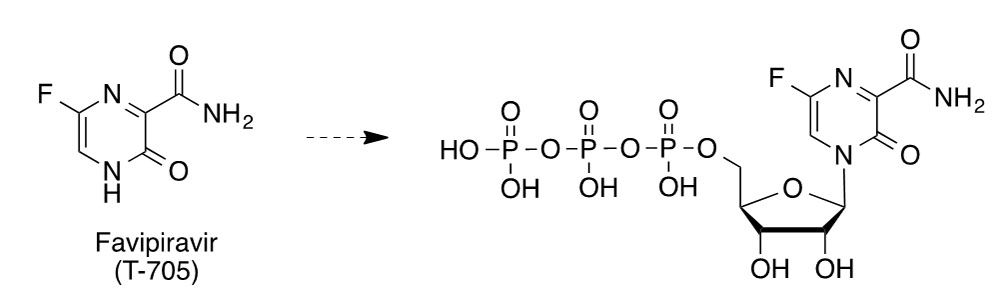
El mecanismo de acción de remdesivir se propuso en estudios previos con el virus MERS. Se trata de un profármaco con estructura de monofosforamidato que se transforma en el C-adenosina nucleósido GS-441524, cuyo trifosfato es una análogo de ATP (trifosfato de adenosina) y otros nucleótidos, compitiendo con ellos como falso sustrato de la polimerasa de RNA dependiente de RNA (RdRps). Esta enzima se inhibe tras la incorporación de este falso nucleótido a la cadena de RNA en crecimiento, de forma que cuando se incorpora a la posición i, el crecimiento de la cadena de RNA se paraliza en la posición i+ 3 (7). Favipiravir (T-705, Avigan®) es un profármaco antigripal que parece tener buenas perspectivas. Su actividad antiviral se descubrió en el cribado de una biblioteca de compuestos en la compañía ja- ponesa Fujifilm. Su ribofosforilación intracelular da lugar a su forma activa, el correspondiente nucleótido en forma de trifosfato. Éste inhibe la polimerasa RNA dependiente de RNA (RdRp) y acelera la curación de COVID-19 si se administra pronto, aunque no parece funcionar tan bien cuando el virus ya se ha multiplicado. Desde el año 2014 está comercializado como antigripal en Japón, habiéndose ensayado clínica- mente contra COVID-19 en Wuhan y Shenzen (China). Dos estudios realizados con un total de 340 pacientes, indican que favipiravir reduce el tiempo que necesitan estos enfermos para eliminar el virus de su organismo.
La empresa farmacéutica francesa Sanofi y el laboratorio estadounidense Regeneron han apostado por estudiar un anticuerpo monoclonal humano contra el receptor de la citocina interleucina-6 (IL-6). Este anticuerpo se denomina sarilumab (Kevzara®) que, análoga- mente al previamente conocido tocilizumab ( Actemra®), se había desarrollado actividad antiinflamatoria para el tratamiento de la artritis reumatoide en combinación con metotrexato, habiendo recibido la aprobación de la FDA. En un estudio inicial realizado en China con 21 pacientes, se observaron evidencias de que IL-6 puede jugar un papel muy importante en la respuesta inmune inflamatoria que causa la dificultad respiratoria aguda en pacientes críticamente enfermos de COVID-19. Ambas compañías comenzarán a evaluar esta actividad en ensayos de fase 2/3 que se realizarán en Estados Unidos y en varios países de Europa, y Sanofi está investigando, además, posibles vacunas.
5. VACUNAS
La pugna por la primicia de una vacuna contra el nuevo coronavirus SARS-CoV-2 es una carrera contrarreloj de ámbito mundial, ya que el primero en conseguirlo recibirá el reconocimiento mundial junto con una patente muy valiosa.
Es reconocido por todos que la vacunación podría ser el pro-ceso más útil para prevenir y controlar enfermedades infecciosas. Aunque el desarrollo de las vacunas estuvo dirigido en un principio a la prevención de enfermedades infecciosas causadas por microorganismos en personas y animales, a partir de 1980 empezó a dirigirse hacia otras enfermedades, incluido el cáncer (8). Las vacunas basadas en el uso de organismos muertos o de patógenos vivos con virulencia atenuada (LAV), han tenido y tienen un enorme éxito en el control y erradicación de infecciones humanas muy graves, como la viruela, polio, sarampión, paperas o rubeola. Aunque su virulencia está reducida, la respuesta inmune (en la que se producen anticuerpos neutralizantes y se activan linfocitos T para destruir las células infectadas) es muy grande, lo que es muy importante para atacar a patógenos intracelulares como los virus. Sin embargo, estas vacunas pueden producir enfermedades en personas inmunodeprimidas o revertir a formas virulentas debido a mutaciones o a su recombinación con otras formas biológicas transmisibles (9).
La vacunación por administración de DNA o RNA no libera- dos desde un virus, mimetiza a la infección e inmunización causadas por microorganismos vivos, siendo capaz de estimular a las células T cooperadoras foliculares (Tfh) y a la respuesta inmune mediada por los linfocitos B, que reconocen antígenos extraños al organismo a través de sus receptores de membrana (10).
La fabricación de estas vacunas es segura, rápida, y con menos riesgos de contaminación que los que conlleva el manejo de patógenos peligrosos. Sin embargo, si se utilizan moldes de ADN para expresar el antígeno, éstos deben primero atravesar las membranas citoplasmáticas y nucleares para transcribirse a mRNA, y volver después al citoplasma para iniciar la traducción. La complejidad de este proceso es responsable de la escasa potencia que mostraron estas vacunas en sus primeros ensayos clínicos (11). Aunque su eficacia ha aumentado con la aplicación de nuevas tecnologías para optimizar su farmacocinética, todavía persiste el riesgo de que el DNA exógeno se integre en el genoma del huésped y pueda inducir nuevas enfermedades. Por todo lo anteriormente comentado, las vacunas mRNA tienen ventajas sobre las vacunas DNA.
Desde que se supo que el mRNA transcrito in vitro podía expresarse in vivo tras ser inyectado en músculos de ratones, empezó a pensarse en su utilización para la elaboración de vacunas, ensayándose por primera vez a principios de los años 1990 (12). En la última dé- cada, se han llevado a cabo ensayos en melanoma metastático, carcinoma de células renales, cáncer de próstata, y otros tipos de cáncer (13), y aunque sigue habiendo problemas debidos a la inestabilidad que producen las ribonucleasas, su baja inmunogenicidad, y su producción a baja escala, estas vacunas son más ventajosas que las que utilizan vectores víricos o DNA. La síntesis de vacunas mRNA puede realizarse a través de una transcripción enzimática libre de células que tiene como componentes esenciales a los trifosfatos de nuclósidos, a plásmidos DNA que codifican al mRNA de la vacuna, y a una polimerasa RNA. Se puede aumentar la estabilidad y la eficacia de la traducción modificando el RMN, pero además, pueden utilizarse técnicas adicionales como la encapsulación en liposomas. La pureza del mRNA es esencial en el proceso de traducción, y la contaminación con RNAs derivados de la actividad de polimerasas de RNA aberrantes conduce a la inhibición de la traducción y a la degradación del mRNA, con la consiguiente disminución en la producción de proteínas (14).
El antígeno transcrito, se presenta al sistema inmune. En este proceso de reconocimiento de la vacuna por los sensores celulares, las vacunas mRNA no requieren un adyuvante inmunológico para reforzar la respuesta inmune porque RNA es el ligando de los receptores toll- like 7 y 8, que están implicados en la iniciación de la respuesta inmune innata y adaptada y reconocen una gran variedad de patrones mole-culares. Estos receptores son glicoproteínas, cuyo dominio intracelular es responsable de la correspondiente vía de señalización descendente. Aunque los efectos de las vacunas mRNA en humanos no se han estudiado todavía en toda su extensión, los avances que se han logrado con ellas justifican el apoyo que obtienen de los fondos privados y de las instituciones para soportar los gastos de su investigación y desarrollo (15). Algunos expertos opinan que las primeras vacunas mRNA contra COVID-19 estarán pronto disponibles porque son fáciles de fabricar y darán cierta protección, aunque la duración de ésta es dudosa. Comentaremos algunos ejemplos entre las muchas compañías y grupos de investigación dedicados actualmente a desarrollar una vacuna eficaz contra esta pandemia. La compañía “ARN Arcturus Therapeutics”, con sede en San Diego (California) investiga una vacuna para COVID-19 cuyo enfoque es el ARN autorreplicante.
La empresa BioNTech, situada en Maguncia (Renania-Pala- tinado, Alemania), Pfizer, y la compañía farmacéutica Fosun Pharma ubicada en Shanghái, desarrollarán conjuntamente en Europa, EEUU y China una potencial vacuna mRNA contra COVID-19 denominada BNT162. El inicio de los ensayos clínico a finales de abril se anunció el mismo día que comenzaba oficialmente en España el estado de alarma sanitaria tratando de ralentizar la expansión de este virus.
Otra compañía farmacéutica alemana con base en Turingia denominada “CureVac”, trabaja en colaboración con el Instituto Paul Ehrlich para desarrollar una vacuna que, al parecer, tiene posibilidades, aunque la empresa descarta que esté disponible antes de un año. La compañía biotecnológica estadounidense “Moderna Therapeutics”, con base en Massachusetts, ha desarrollado junto al NIH otra vacuna mRNA denominada mRNA-1273 que ya ha empezado a ensayarse en Seattle con 45 adultos voluntarios sanos. Ésta está diseñada para atacar una forma estabilizada de la proteína S.
Hacia mitad de marzo, varias instituciones chinas también anunciaron que pondrían en marcha en abril ensayos clínicos para comprobar la eficacia de varias vacunas que el país está desarrollando contra el coronavirus SARS-CoV-2. El Ministerio de Defensa, en concreto, comunicaba que el equipo de la epidemióloga Chen Wei, conocida por haber liderado un equipo para crear una vacuna contra el virus del Ébola, había desarrollado con éxito una vacuna que podía fabricarse a gran escala y estaba basada en vectores virales de la gripe. Al parecer disponía del permiso para iniciar los ensayos clínicos, aun- que no se precisaba la fecha exacta de comienzo.
En España, dos equipos del Centro Nacional de Biotecnología (CSIC) trabajan en distintas estrategias para conseguir una vacuna contra esta pandemia. La vacuna que prepara el equipo del Dr. Enjuanes se basa en generar un virus completo SARS-CoV-2 al que se le han eliminado regiones de virulencia, por lo que se trata de un virus atenuado. Este equipo utilizó una táctica semejante para desarrollar una vacuna contra SARS en 2014, nada más terminar el brote de esta enfermedad. Sus características se perfeccionaron en 2016, pero que no llegó a comercializarse porque el virus surgido en 2002 desapareció y no ha vuelto a detectarse.
La aproximación que sigue el equipo del Dr. Mariano Esteban (Jefe del Grupo Poxvirus y Vacunas en el CNB) para conseguir una va- cuna contra COVID-19, se basa en la inducción de anticuerpos neutralizantes frente al SARS-CoV-2 por un vector atenuado del virus vaccinia, Modified Vaccinia Ankara (MVA), que expresa el gen completo que codifica la proteína S (spike) del coronavirus. Esta misma aproximación la ha seguido anteriormente en la producción de vacunas frente a otros virus emergentes como Chikungunya, Ébola y Zika, induciendo altos porcentajes (80-100%) de protección en modelos animales. El Dr. Esteban, que investiga también en los últimos años una potencial vacuna contra el HIV que ya ha empezado a probarse con buenos resultados, espera obtener el virus recombinante con la secuencia completa en un mes, y luego demostrar que induce anticuerpos neutralizantes.
Por su parte, la empresa Takeda ha iniciado el estudio de un tratamiento con globulina hiperinmune (H-IG) extraída del plasma de pacientes que han superado la enfermedad o han sido vacunados. Esta inmunización pasiva se ha mostrado eficaz en otras infecciones respiratorias graves, y es una de las recomendadas por el virólogo español García Sastre, Director de Salud Global y Patógenos Emergentes del Hospital Monte Sinai en Nueva York.
Aún se ignoran datos fundamentales sobre el nuevo patógeno que son esenciales para estimar su progresión, pero ojalá que podamos oir en un futuro próximo de esta pandemia algo parecido al comentario que hizo en 2004 el Dr. Heymann, responsable de la unidad de enfermedades infecciosas de la OMS durante la pandemia del SARS: “La respuesta al SARS se benefició de la buena fortuna y la buena ciencia”.
6. REFERENCIAS
01. Kirchdoerfer, R. N.; Cottrell, C. A.; Wang, N.; Pallesen, J.; Yassine, H. M.; et al. Prefusion structure of a human coronavirus spike protein. Nature 2016; 531, 118-121.
02. Yang, Y.; Liu, C.; Du, L.; Jiang, S.; Shi, Z.; et al. Two mutations were critical for bat-to-human transmission of Middle East respiratory syndrome coro- navirus. J. Virol. 2015; 89, 9119-9123.
03. Zhao, J.; Li, K.; Wohlford-Lenane, C.; Agnihothram, S. S.; Fett, C.; et al. Rapid generation of a mouse model for Middle East respiratory syndrome. Proc. Natl. Acad. Sci. USA. 2014; 111, 4970-4975.
04. Tang, X.; Wu, C.; Li, X.; Song, Y.; Yao, X ; et al. On the origin and continuing evolution of SARS-CoV-2. Natl. Sci. Rev. 2020; DOI: 10.1093/nsr/nwaa036.
05. Cao, B.; Wang, Y.; Wen, D.; Liu, W.; Wang, J.; et al. A trial of lopinavir-ri- tonavir in adults hospitalized with severe Covid-19. New Eng. J. Med. 2020; doi:10.1056/NEJMoa2001282.
06. Colson, P.; Rolain, J.-M.; Raoult D. Chloroquine for the 2019 novel coro- navirus – ResearchGate. International Journal of Antimicrobial Agents 2020; 55, 105923.
07. (a) Agostini, M. L.; Andres, E. L.; Sims, A. C.; Graham, R. L.; Sheahan, T. P.; et al. Coronavirus Susceptibility to the Antiviral Remdesivir (GS-5734) Is Mediated by the Viral Polymerase and the Proofreading Exoribonuclease. mBio 2018; 9, e00221-18. 08. (b) Gordon, C. J.; Tchesnokov, E. P.; Feng, J. Y.; Porter, D. P. Götte, M. The antiviral compound remdesivir potently inhibits RNA-dependent RNA polymerase from Middle East respiratory syndrome co- ronavirus. Journal of Biological Chemistry 2020; Manuscript AC120.013056. Cuzick, J. Preventive therapy for cancer. Lancet Oncol. 2017; 18, e472- e482.
09. Zhou, B.; Meliopoulos, V. A.; Wang, W.; Lin, X.; Stucker, K. M.; et al. Re- version of cold-adapted live attenuated influenza vaccine into a pathogenic virus. J. Virol. 2016; 90, 8454-8463.
10. (a) Pardi, N.; Parkhouse, K.; Kirkpatrick, E.; McMahon, M.; Zost, S. J.; et al. Nucleoside-modified mRNA immunization elicits influenza virus hemag- glutinin stalk-specific antibodies. Nat. Commun. 2018; 9, 3361. 11. (b) Pardi, N.; Michael J.; Hogan, M. J.; Porter, F. W.; Weissman, D. mRNA vaccines – A new era in vaccinology. Nat. Rev. Drug Discov. 2018; 17, 261-279.
12. Kutzler, M. A.; Weiner, D. B. DNA vaccines: Ready for prime time? Nat. Rev. Genet. 2008; 9, 776-88.
Wolff, J. A.; Malone, R. W.; Williams, P.; Chong, W.; Acsadi, G.; et al. Direct gene transfer into mouse muscle in vivo. Science 1990; 247, 1465- 1468.
13. Savelyeva, N.; Ottensmeier, Ch. (Editors). “Cancer Vaccines”. Current Topics in Microbiology and Immunology. Springer International Publishing AG 2017.
14. Weissman, D. mRNA transcript therapy. Expert Rev. Vaccines 2015; 14, 265-281.
15. Cuiling Zhang, C.; Giulietta Maruggi, G.; Shan, H.; Li, J. Advances in mRNA Vaccines for Infectious Diseases. Front. Immunol. 2019, 10:594. doi: 10.3389/fimmu.2019.00594 .