La obesidad es un síndrome crónico, reversible, recidivante y muy prevalente caracterizado por incremento de la adiposidad corporal. El acúmulo graso a nivel abdominal está asociado con multitud de patologías y complicaciones clínicas, de ahí la importancia de su prevención y tratamiento. Un balance energético negativo, mediante la reducción de la ingesta calórica y/o el incremento del gasto energético, constituye la piedra angular del tratamiento médico-nutricional. Las dietas bajas en calorías (LCD) y muy bajas en calorías (VLCD) han demostrado eficacia en la pérdida de peso y grasa corporal. A su vez, la modificación de la proporción de macronutrientes ha permitido el diseño de dietas hipocalóricas ricas en carbohidratos y reducidas en grasa (LFD), bajas en carbohidratos (DBCa), dietas cetogénicas muy bajas en hidratos de carbono (VLCKD), dietas de bajo índice glucémico (LGI) y dietas con alto contenido en proteínas, cada una con impactos diferenciados sobre la composición corporal y la sensibilidad insulínica, si bien con reducciones similares ponderales a largo plazo. La crononutrición, que incluye la restricción de tiempo en la alimentación y el ayuno intermitente, supone una estrategia reciente para la obesidad y mejora de marcadores de riesgo cardiometabólicos. El impacto de los micronutrientes y compuestos bioactivos en la regulación metabólica de la obesidad sigue siendo objeto de investigación, con especial mención a frenar la oxidación e inflamación de bajo grado asociada al exceso de peso. El tratamiento dietético de la obesidad debe ser adaptado y personalizado, considerando las características individuales y la adherencia del paciente a largo plazo.Palabras clave: Obesidad; Balance energético; Dietas hipocalóricas; Macronutrientes; Compuestos bioactivos; Nutrición personalizada; Pérdida de peso
ABSTRACT:
Obesity is a chronic, reversible, recurrent and highly prevalent syndrome characterised by increased adiposity. Abdominal fat accumulation is associated with a multitude of complications diseases, hence the importance of multifocal prevention and treatment. Creating a negative energy balance by reducing calorie intake and/or increasing energy expenditure is the cornerstone of medical and nutritional management. Low-calorie diets (LCD) and very low-calorie diets (VLCD) have been shown to be effective in body weight and body fat loss. In turn, modifying the proportion of macronutrients has allowed the design of low-calorie diets rich in carbohydrates and low in fat (LFD), low-carbohydrate diets (LCD), very low-carbohydrate ketogenic diets (VLCKD), low-glycaemic index diets (LGI) and high-protein diets, each with different impacts on body composition and insulin sensitivity, although with similar long-term weight reductions. Chrononutrition, which includes time-restricted eating and intermittent fasting, are recent strategies for obesity therapies and mitigating cardiometabolic risk factors. Moreover, the impact of micronutrients and bioactive compounds on the metabolic regulation of obesity remains under investigation, with a particular focus on slowing down the low-grade oxidation and inflammation that occur. Dietary treatment of obesity should be tailored and personalized, taking into account individual characteristics and long-term patient adherence.Keywords: Obesity; Energy balance; Low-calorie dietsMacronutrientsBioactive compounds; Personalized nutrition; Weight loss
1. INTRODUCCIÓN
La obesidad ha sido definida como un síndrome de carácter crónico, reversible y recidivante, que se caracteriza por un acúmulo anormal de grasa en el organismo, que está habitualmente asociado a un peso corporal desproporcionadamente elevado respecto a la talla del paciente(1), asociado a un exceso de tejido adiposo(2,3). Actualmente se acepta la clasificación de la obesidad dependiendo de la localización del exceso de adiposidad central, androide o con forma de manzana, con acumulación de grasa subcutánea o perivisceral en la parte superior del cuerpo, pectorales y abdomen; periférica, ginecoide o ginoide con forma de pera, con predominio de grasa subcutánea entre caderas y rodillas (glúteos y muslos); y homogénea, con distribución uniforme del exceso graso en todo el cuerpo (4). La adiposidad excesiva está relacionada con un incremento de la mortalidad (1–3) y mayor riesgo de complicaciones cardiometabólicas como diabetes mellitus tipo 2 (DMT2), hipertensión arterial (HTA), dislipemia (DLP), recientemente renombrada enfermedad metabólica esteatósica (5), enfermedad cardiovascular (ECV), artrosis, apnea obstructiva del sueño (AOS), síndromes psicológicos/psiquiátricos, diferentes tipos de cáncer (mama, endometrio, ovario, hígado, colon, etc.), entre otras manifestaciones y comorbilidades (2,6), mientras que la obesidad ginoide es más abundante en mujeres y se asocia con várices y problemas osteoarticulares (7). La obesidad se ha clasificado atendiendo al índice de masa corporal (IMC: kg/m2) en obesidad de tipo I (30-34,9 kg/m2), tipo II (35-39,9 kg/m2), tipo III o mórbida (de 40-49,9 kg/m2) y tipo IV o extrema (>50 kg/m2) (2); edad de diagnóstico o aparición (infantil, puberal, del adulto), evolución en el tiempo (aguda, crónica, estática, dinámica) y la presencia o ausencia de ciertos marcadores lipoproteicos e inflamatorios se ha clasificado en obesidad metabólicamente sana o mórbida (8). Recientemente, un grupo de expertos en obesidad ha llegado al consenso de diferenciar desde el punto de vista clínico y de prevención entre obesidad clínica y preclínica. Ha definido a la obesidad clínica como una enfermedad crónica y sistémica caracterizada por alteraciones en la función de uno o más tejidos y órganos debido al exceso de adiposidad, insistiendo en que debe huirse del IMC como método de diagnóstico y utilizar métodos sencillos, pero más precisos y discriminantes como el perímetro de cintura o la relación del perímetro de cintura/perímetro de cadera (9), así como la bioimpedanciometría cuando sea posible.
En la actualidad, más de mil millones de personas en todo el mundo padecen sobrepeso u obesidad (10). Los datos reportados por Global Burden of Disease (GBD) estiman que para el año 2030 el 57,8% de la población mundial padecerá exceso de peso (11). La obesidad aumenta la probabilidad de varias enfermedades y condiciones que están vinculadas a una mayor mortalidad prematura (1,6). En 2030, los costes sanitarios debidos a patologías relacionadas con la obesidad rondarán los 57,100 millones de euros por año en EE. UU. (12). En España, en 2019, el impacto económico del sobrepeso y la obesidad alcanzó los 27.600 millones de euros. Este cálculo equivale al 2,1% del Producto Interior Bruto español. Los costes directos y los costes indirectos representaron el 38,9% y el 61,1% del coste total sanitario, respectivamente. Para 2060, se prevé que los impactos económicos aumenten a 58.300 millones de euros, lo que representa duplicar los costos totales derivados del sobrepeso o la obesidad (13). En 2025, un estudio español estima que una pérdida de peso del 15% en una población de 100.000 adultos con IMC 30–50 kg/m² podría reducir de manera significativa el riesgo relativo de diversas comorbilidades, suponiendo un ahorro acumulado de 105 millones de euros en costes sanitarios (14). Las estrategias terapéuticas disponibles para el tratamiento de la obesidad suelen seguir un orden escalonado, induciendo la pérdida de peso mediante la restricción energética e incrementando la actividad física programada como primeras pautas de tratamiento, y el tratamiento farmacológico o quirúrgico, para casos refractarios o como terapia puente (1,4). La nutrición personalizada en obesidad emplea tecnologías “ómicas” como la nutrigenética, nutrigenómica, epigenómica, metabolómica y metagenómica para comprender las relaciones que existen entre los genes, el metabolismo y el microbioma, influyendo en la respuesta a la dieta y el tratamiento (15). En cuanto al tratamiento farmacológico, los análogos del péptido similar al glucagón tipo 1 (GLP1) y los fármacos duales que asocian análogos del polipéptido inhibidor gástrico, también llamado péptido insulinotrópico dependiente de la glucosa (GIP), con análogos de la GLP-1 son un grupo de fármacos con efecto incretina que están siendo una revolución en los pacientes con obesidad y sus complicaciones clínicas asociadas. Entre ellos citaremos la Liraglutida administrada por vía subcutánea (sc) 3 mg/día, Semaglutida por vía sc a dosis de 2,4 mg/semana (16,17) y la Tirzepatida a dosis de 5-15 mg/semana vía sc (17,18). Las acciones beneficiosas basadas en la activación del “eje enteroinsular” son complejas y tienen múltiples objetivos, involucrando el intestino, cerebro, páncreas e hígado (19). En particular, los efectos reductores de peso de semaglutida y tirzepatida, han modificado el paradigma del tratamiento farmacológico de la obesidad, no solo por sus efectos ponderales, sino por sus beneficios cardiometabólicos y marcadores inflamatorios del metabolismo glucídico y lipídico que conllevan (17,18). No obstante, los efectos secundarios y las posibles interacciones con otros fármacos (p. ej., con los inhibidores de DPP4)(20), requieren mucha prudencia y la utilización inicial de las dosis más reducidas, siempre en el marco de una dieta hipocalórica y ejercicio efectivos y correctos.
Dado los resultados de algunos estudios en marcha, se espera que la oferta de fármacos antiobesidad se extienda al uso de otros agonistas duales (GLP-1 y análogo de la amilina) o triales (análogos de la GLP-1, GIP y glucagón), con pérdidas previstas del 25% o más en el peso corporal (21,22). La cirugía bariátrica está indicada en paciente con IMC ≥ 40 kg/m2 o ≥ 35 kg/m2 con complicaciones metabólicas asociadas (DMT2, HTA, MetS, AOS, etc.) (1,2).
De hecho, la pérdida de peso suele ir acompañada de múltiples con reducción del riesgo cardiometabólico, como el aumento de la sensibilidad a la insulina y la mejora de los perfiles lipídicos circulantes, la reducción de la presión arterial y de marcadores de inflamación (16,23,24). Los factores fenotípicos, genéticos y ambientales pueden contribuir a las diferencias interindividuales en la respuesta a las prescripciones de estilo de vida saludable (25), lo que abre la puerta a estrategias de nutrición/medicina personalizada para el tratamiento de la obesidad o la DMT2 y la prevención de la ECV basadas en la individualización del paciente mediante marcadores específicos y de precisión (26–28).
2. MODIFICACIONES EN EL ESTILO DE VIDA Y PESO CORPORAL
La “modificación del estilo de vida” sigue siendo la piedra angular del tratamiento de la obesidad (1,29), pues incide en el concepto de que la obesidad es una “enfermedad de hábitos” particularmente relacionada con una ingesta calórica excesiva y un gasto energético deficitario asociado al sedentarismo. Esta modificación persigue modificar el balance energético (30) reduciendo la energía dietética derivada de los macronutrientes y el etanol y/o aumentando el gasto calórico (1,31).
El gasto total de energía se considera la suma de la tasa metabólica en reposo, el efecto termogénico de los alimentos y la utilización de energía relacionada con la actividad física, junto con la termogénesis sin actividad física (32). La pérdida de peso corporal y de grasa está basada generalmente en producir un déficit energético, es decir, un balance calórico negativo (33).
A los pacientes con obesidad se les aconseja una pérdida de al menos un 10% del peso corporal mediante una combinación de dieta, actividad física y terapia conductual (1,4,6). Las pautas dietéticas pueden lograr una pérdida de peso significativa a corto plazo mediante el consumo de dietas con porciones controladas y bajo contenido energético (34). En muchos casos, la modificación del estilo de vida da como resultado una pérdida drástica de peso corporal, lo que conduce a una reducción significativa del riesgo cardiovascular (35). Los resultados de la revisión sistemática de la Guía para el manejo del sobrepeso y la obesidad en adultos de la American Heart Association/American College of Cardiology/ The Obesity Society (AHA/ACC/TOS) mostraron que las dietas bajas en calorías (LCD) (800-1800 kcal/día), cuando se combinaron con la modificación del estilo de vida, indujeron pérdidas de peso promedio de 5 a 8 kg en 6 meses, que se mantuvieron en 1 año con asesoramiento continuo sobre el estilo de vida (36).
Dado que las elecciones de alimentos están determinadas principalmente por el entorno de las personas, como son los hábitos familiares y sociales (1), se deben modificar las políticas comunitarias para potenciar el diseño y desarrollo de alimentos con bajo contenido de azúcar (sacarosa y fructosa), grasa saturada y sal, así como disminuir la disponibilidad de alimentos hipercalóricos consumidos preferentemente por los niños (37). Las intervenciones dirigidas a establecer hábitos de vida saludables (p. ej., educación nutricional, incentivos para una vida saludable, impuesto a los alimentos hipercalóricos/procesados, etc.), y el control de las causas responsables del exceso de peso poblacional, como la Estrategia NAOS (38), enfocada en fomentar la nutrición y la actividad física para invertir la tendencia de la obesidad. Incluyen también el Código PAOS, que corregula la publicidad de alimentos dirigida a menores, acuerdos de reformulación con la industria para reducir nutrientes críticos como sal, grasas y azúcares en alimentos procesados, y políticas fiscales para modificar precios incentivando opciones saludables y penalizando las menos recomendables, probablemente tengan un fuerte impacto en la lucha contra el incremento de obesidad (39–41).
2.1 Tratamiento médico-nutricional para la pérdida de peso
La base nutricional del tratamiento de la obesidad se orienta fundamentalmente a conseguir un balance negativo de energía, particularmente a través de la prescripción de dietas hipocalóricas, que provoquen reducciones del peso, del IMC y de la adiposidad, especialmente a nivel central, a fin de mejorar los aspectos metabólicos y patológicos asociados a la obesidad. El tratamiento deberá garantizar, además, el mantenimiento de las pérdidas de peso y grasa a largo plazo. Dada la alta prevalencia de Diabesity (42) y, por ende, de resistencia a la insulina en los individuos obesos, el tratamiento se orientará a los cuatro aspectos que se señalan a continuación (43).
1. Reducir el ingreso energético y/o incrementar el gasto energético.
a) Consumo de dietas hipocalóricas
b) Consumo adecuado de agua y otras bebidas.
c) Disminución del apetito
d) Incremento de las señales de saciedad
e) Aumento del efecto termogénico de los alimentos.
2. Disminuir la absorción de macronutrientes y/o energía.
a) Incremento de la velocidad del tránsito intestinal.
b) Disminución de la digestión y absorción de lípidos, hidratos de carbono, y proteínas.
3. Promover efectos sobre el metabolismo energético.
a) Modificación de la respuesta glucémica e insulinémica de la dieta.
b) Normalización de la insulinemia
c) Disminución de la lipogénesis en el tejido adiposo.
d) Incremento de la actividad metabólica general, con actividad mitocondrial.
4. Otras orientaciones del tratamiento dietético.
a) Normalización o mejora del perfil de la microbiota intestinal y su
relación con el hospedador
b) Búsqueda de beneficios epigenéticos y de interacciones apropiadas
entre dieta y genoma.
La oferta de pautas dietéticas frente a la obesidad presenta una amplia gama de regímenes alimenticios destinados a la reducción de peso. Sin embargo, la mayoría de ellos no logran alcanzar los resultados deseados a largo plazo, debido a la falta de garantías en cuanto a su adherencia y el mantenimiento de la pérdida de grasa, así como por los efectos negativos que conllevan, especialmente a nivel cardiometabólico (44,45), existiendo diversas aproximaciones dietéticas terapéuticas (Tabla 1).
Tabla 1. Tipos de tratamientos restrictivos acorde al aporte energético y posible prescripción según el grado de Obesidad y sobrepeso al que se apliquen.
2.1.1 Dietas tipo ayuno modificado
Estas dietas se aconsejan para obesidades graves y extremas como pauta de partida y en periodos menores a una semana (43), debido a sus efectos indeseables (posible mortalidad incrementada, letargia, pérdida excesiva de proteínas, etc.), donde su contenido proteico varía entre 0 y <50 g/día.
2.1.2 Dieta muy baja en calorías (VLCD)
Las dietas VLCD del inglés “Very Low Calorie Diet” prescriben menos de 800 kcal/día manteniendo el objetivo de proporcionar nutrientes esenciales, aunque suelen estar suplementadas con vitaminas y minerales (46). Tanto la LCD como la VLCD proporcionan aproximadamente de 70 a 100 g/día de proteínas, diseñadas para controlar la pérdida de masa corporal magra (36,47). La Guía para el tratamiento del sobrepeso y la obesidad en adultos de la AHA/ACC/TOS de 2013 sugirió que las VLCD se prescribieran en casos limitados, como en la preparación para una cirugía bariátrica (47). Las VLCD solo deben usarse como parte de una intervención integral en el estilo de vida con la supervisión médica adecuada, debido a las rápidas pérdidas de peso y los posibles efectos secundarios, como por ejemplo colelitiasis, deshidratación, entre otros (48). Cuando los pacientes alcancen los objetivos de pérdida de peso establecidos, la ingesta energética debe aumentarse gradualmente hasta un nivel compatible con su nuevo peso corporal (p. ej., aumentar cada semana 100 kcal hasta estabilización del peso). En un reciente metaanálisis de ensayos clínicos, los participantes asignados al azar a VLCD junto con modificación del estilo de vida perdieron 10,3 kg (durante una media de 10 semanas) (49).
2.1.3 Dieta baja en calorías (LCD)
Las dietas bajas en calorías (LCD, por sus siglas en inglés Low Calorie Diet) generalmente se definen por objetivos de consumo de energía de 800 a 1.800 kcal/día (46). Estos regímenes agrupan a las dietas hipocalóricas severas y moderadas (Tabla 1). Una prescripción común es de 1.200 a 1.500 kcal/día para personas que pesan menos de 115 kg y de 1.500 a 1.800 kcal/día para quienes pesan al menos 115 kg. Alternativamente, se puede prescribir un déficit de energía de 500 a 750 kcal/día según las estimaciones del gasto de energía, teniendo en cuenta el grado de actividad metabólica que presente el paciente (36) o también una restricción personalizada del 30% sobre el gasto energético calórico, como se demostró en el proyecto NUGENOB “Nutrient-Gene interactions in human Obesity” (50). Las LCD prescriben un perfil equilibrado de nutrientes, similar a las recomendaciones para la población general (es decir, 45–65 % de energía proveniente de carbohidratos, 20–35 % de energía proveniente de grasas (≤10 % de kcal grasas saturadas) y 10–35 % de energía proveniente de proteínas) (51). Un estudio evidenció que las LCD prescritas durante un promedio de 12,7 semanas inducen una pérdida media del 9,7 % del peso inicial en comparación con el 16,1 % de las VLCD (49).
En la actualidad existe general aceptación entre los profesionales de la salud para prescribir dietas hipocalóricas balanceadas tipo mediterráneo, dado el equilibrio entre los macronutrientes aportados, porque ayudan a reeducar nutricionalmente al paciente y por sus beneficios cardiometabólicos, donde será obligatorio el consumo preferentemente de agua en cantidades que superen los 2-2,5 litros/día. Los hidratos de carbono aportarán entre el 50 y 55% de la energía, las grasas el 30% (de las que el 55% será aportado por ácido oleico) y las proteínas el 15-20% restante. El aporte de fibra será variado y de 20-30 gramos/día, ingiriéndose minerales y vitaminas en cantidades que cubran las recomendaciones (52).
2.1.4 Dietas con diferente distribución de macronutrientes
Las dietas con diferentes composiciones de macronutrientes se pueden prescribir mediante restricción calórica o “ad libitum” sin un objetivo calórico específico (bajo la teoría de que la ingesta calórica más baja se logrará mediante la restricción o eliminación de determinados alimentos). Las manipulaciones de macronutrientes más comunes determinan dietas bajas en grasas, bajas en carbohidratos y altas en proteínas (36,53). El proyecto Diabetes, Obesity and Genes (DIOGenes), tuvo como objetivo el análisis del efecto de la ingesta de proteínas (alta/baja) y del índice glucémico (alto/bajo) sobre el mantenimiento del peso y la prevención de la recuperación del peso perdido en una población con exceso de peso, tras prescribir una dieta baja en calorías (54). Encontrar la proporción óptima de macronutrientes para promover la pérdida de peso es uno de los objetivos de la medicina de precisión y la nutrición personalizada (15,53). Así, la adaptación macronutricional y temporal (horarios de comidas) tiene un impacto no sólo en la pérdida de peso, sino que también proporciona beneficios a nivel cardiometabólico, como de la sensibilidad insulínica (55), a través de reducir el apetito/mayor saciedad (56) o aumento de la termogénesis, inducida por la proteína (24).
Los diferentes tipos de estrategias dietéticas, contenido en macronutrientes, tiempos de duración, así como su repercusión en cuanto a la pérdida de peso de la prescripción personalizada de dietética en cuanto a la pérdida de peso terminal (Tabla 2).
Tabla 2: Resumen esquemático de diferentes estrategias dietéticas, tiempos de duración y peso perdido.
2.1.5 Papel del contenido en hidratos de carbono de la dieta
Las dietas bajas en carbohidratos (DBCa) enfatizan la restricción de carbohidratos y su reemplazo con grasas y/o proteínas (36,46). Las DBCa prescriben de 60 a 130 g de carbohidratos por día (≤20% al 45% de la ingesta diaria de energía). Los regímenes muy bajos en carbohidratos recomiendan menos de 60 g de carbohidratos por día (36). En comparación con las dietas bajas en grasa (LFD), las DBCa produjeron una pérdida de peso de 3,3 a 4,0 kg mayor a los 6 meses (57). En una revisión sistemática publicada en “The Cochrane Library”, describieron que existía una cierta controversia en cuanto a la pérdida de peso entre los ensayos clínicos revisados, al comparar DBCa con una dieta equilibrada en carbohidratos, obteniéndose que los resultados en cuanto a la pérdida de peso variaron entre 1 y 12 kg para ambas dietas (58).
2.1.6 Dietas cetogénicas muy bajas en carbohidratos
Las dietas cetogénicas muy bajas en carbohidratos (VLCKD de sus siglas en inglés “Very Low Calorie Ketogenic Diet”) son una de las formas más populares de LCD y se acompañan de cetosis (46,59,60). Estos regímenes restringen los carbohidratos a menos de 20 g/día durante la fase 1, que por lo general dura hasta 12 semanas, y luego lo aumentan gradualmente a 80 a 100 g/día (36). Un metaanálisis de seis estudios de VLCKD, reveló una pérdida de peso media de 10,0 kg con un seguimiento medio de 4 semanas, así como una reducción en el colesterol total (-28 mg/dL), triglicéridos (-30 mg/dL) y una reducción en la tensión arterial de ~8 mmHg (58).
2.1.7 Índice glucémico, carga glucémica y fibra en la dieta
El índice glucémico (IG) es una medida que refleja la capacidad de un alimento para aumentar los niveles de glucosa en sangre, y se determina al comparar la variación postprandial de glucosa en sangre que produce ese alimento con uno de referencia (pan blanco o glucosa pura) tras un periodo de ayuno (60). El valor del IG oscila entre 0 y 100, interpretándose un IG bajo como 55 o menos, un IG medio entre 56 y 69 y un IG alto como 70 o más (61). Los alimentos con IG bajo se digieren y absorben más lentamente, provocando un aumento más lento y constante de la glucemia; en cambio, los alimentos con un IG alto se digieren y absorben más rápidamente, lo que provoca un aumento más rápido de los niveles de glucosa en sangre (62). El valor IG se ve afectado por el tipo de hidrato de carbono, la fibra, la proteína, la grasa y la forma del alimento, entre otros muchos factores (63). Por ejemplo, el IG de muchas frutas aumenta a medida que maduran; en las pastas depende del tiempo de cocción de la pasta, es decir, un tiempo de cocción más largo aumentaría el valor IG (64).
Las dietas de bajo índice glucémico (LGI, de sus siglas en inglés) representan otro enfoque dietético bajo en carbohidratos (36,46,65). La cantidad y el tipo de hidratos de carbono (p. ej., cereales integrales frente a cereales refinados) tienen efectos diferenciales sobre el pico de insulina después de la ingesta (36). En comparación con las dietas de control isocalóricas, los LGI produjeron pérdidas de peso similares o superiores (66). Las dietas de alto y bajo índice glucémico dieron como resultado una pérdida de peso similar a los ≥ 6 meses (67). Aunque la evidencia no está clara, generalmente se estima que las LGI suelen tener efectos más favorables sobre la glucosa (68). El ensayo multicéntrico aleatorizado controlado CARMEN (69) tuvo como objetivo estudiar el impacto de una dieta con bajo contenido en grasas y alto en carbohidratos de diferente digestibilidad (simples y complejos) en pacientes con exceso de peso (IMC: 30,4 ± 2,7 kg/m2), obteniendo pérdidas de peso medias de 1,7 kg para el grupo asignado a carbohidratos simples, y de 2,4 kg para los complejos, siendo significativa la pérdida de masa grasa en ambos grupos respecto a los valores basales. Según los datos de un metaanálisis (N=8.300), el papel de la dieta rica en fibra tiene un efecto protector cardiometabólico; en concreto, sobre el control glucémico, los lípidos en sangre, el peso corporal -0,56 kg (IC del 95 %: -0,98 a -0,13) e inflamación, así como una reducción absoluta de la mortalidad prematura de 14 muertes/1000 participantes (IC del 95 %: 4–19) durante un seguimiento promedio de 8,8 años, al comparar una ingesta diaria de fibra dietética de 35 g con la ingesta promedio de 19 g (70). Un reciente metaanálisis concluyó la relación directa y proporcional del IG con el riesgo de presentar DMT2, presentando un RR de 1,32 (IC del 95%: 1,25–1,40) por cada 10 unidades de IG en la dieta consumida (71).
El concepto de carga glucémica (CG) fue definido para tener en cuenta la contribución a la respuesta glucémica global, no sólo del tipo de hidratos de carbono (según el índice glucémico), sino también de la cantidad de hidratos de carbono disponibles por ración. La CG de un alimento se define como el producto del valor IG del alimento y la cantidad de carbohidratos disponibles en gramos por ración de ese alimento (72). Un valor de CG de 10 o menos se considera bajo, de 11 a 19 medio y de 20 o más alto (73). El tamaño de la ración varía en función de factores dietéticos y culturales (64). Por lo tanto, se espera que un alimento con una CG más elevada aumente la respuesta de la glucosa sérica y la insulina por ración en mayor medida que un alimento con una carga glucémica más baja (60). Los alimentos con alto IG favorecen la hiperglucemia posprandial y la hiperinsulinemia, que conducen al almacenamiento de nutrientes en grasa y al aumento de peso (63), mientras que los alimentos con bajo IG pueden ayudar a controlar el peso al promover la saciedad, regular la secreción postprandial de insulina y mantener la sensibilidad a la insulina (74). Una dieta centrada en una menor CG y mayor ingesta de proteínas se ha relacionado con una mayor pérdida de peso de las personas obesas o con sobrepeso (60). Según un reciente metaanálisis, las dietas bajas en IG/CG muestran una mayor pérdida de peso en adultos con IMC ≥ 30 kg/m2 (-0,93 kg; IC del 95 %: -1,73 kg a -0,12 kg), menores niveles de glucosa en ayunas (-1,97 mg/dl; IC del 95 %: -3,76 a 0,19) y mejora de los niveles de insulina en ayunas (-0,55 µU/ml; IC del 95 %: -0,95 a -0,15; p = 0,007), en comparación con las dietas con un IG/GL alto (75).
2.1.8 Papel del contenido en proteínas en la dieta
Las dietas moderadamente ricas en proteínas prescriben en torno a un 25% de calorías provenientes de proteínas o ≥1,6 g de proteína por kg de peso corporal (36,46,65). Un mayor contenido de proteínas es típico de las dietas bajas en grasas y carbohidratos (36). El ensayo DIOGENES examinó “ad libitum” dietas ricas en proteínas “versus” dietas bajas en proteínas. Tras un tratamiento con LCD inicial de 8 semanas, en comparación con las dietas bajas en proteínas, los participantes asignados al azar a dietas altas en proteínas recuperaron 0,93 kg menos y 2,8 kg menos de peso a las 26 semanas y al año, respectivamente (54,76). Un metaanálisis de 24 ensayos que compararon los efectos a corto plazo (duración media del ensayo de 12 semanas) de dietas con restricción energética, isocalóricas, altas en proteínas/bajas en grasas, con criterios convencionales en proteínas (12-18 % de energía)/bajas en grasas (<30 % del total de energía) encontró diferencias modestas en el peso entre los grupos (–0,79 kg; IC del 95 % = –1,50, –0,08) (77). Por el contrario, una revisión sistemática de 15 ensayos que compararon los efectos a largo plazo (≥12 meses) de una dieta baja en grasa combinada con una ingesta alta o baja de proteínas no encontró diferencias en la pérdida de peso (-0,39 kg; IC del 95 % = -1,43, 0,65) (78). Una reciente revisión sistemática y metaanálisis (79) mostró que las dietas ricas en proteínas (con una contribución al total de la energía entre el 18% y 59%) redujeron el peso corporal en 1,6 kg (IC al 95%: 1,2-2.0) en comparación con el grupo control (restricción energética balanceada). En pacientes con obesidad, pueden aumentar los requerimientos de proteína, estimándose al menos 1.2 g/kg/día durante la pérdida de peso para preservar la masa muscular y evitar la sarcopenia (80). Las diferencias interindividuales pueden depender de fenotipos específicos, lo que indica la necesidad de una visión más personalizada para la prevención y el tratamiento del sobrepeso/obesidad basado en dietas moderadamente altas en proteínas.
2.1.9 Papel del contenido en grasas en la dieta
Las dietas bajas en grasas (DBG, o LFD por sus siglas en inglés) son una estrategia común para perder peso y generalmente prescriben menos del 30% de las calorías provenientes de grasas (36,46,55). La mayoría de las DBG utilizadas para el tratamiento de la obesidad incluyen restricción calórica (81–83). Los estudios “Programa de Prevención de la Diabetes” (DPP) y Look AHEAD, ambos estudios son ensayos clínicos aleatorizados multicéntricos y de gran tamaño, han demostrado la eficacia de las DBG en la pérdida de peso y en mejorar las condiciones comórbidas en comparación con una dieta control (81,84). Las intervenciones bajas en grasas produjeron una pérdida de peso de 3,2 kg más que las del grupo control. El proyecto NUGENOB (50), estudio multicéntrico aleatorizado abierto a dos brazos, con una duración de 10 semanas, tuvo como objetivo la comparación de dos dietas con diferente porcentaje de contenido graso (25% vs 40%), en una población con un IMC ≥30 kg/m2 con un déficit energético del 30%, obteniendo una pérdida de peso media de 6,9 kg (bajo contenido de grasa) y 6,6 kg (alto contenido de grasa). Además, observaron una mejoría en el perfil lipídico en el grupo del 25% de contenido graso, aunque sin encontrar diferencias estadísticas en cuanto a la pérdida de peso.
2.1.10 Micronutrientes y compuestos bioactivos dietéticos: obesidad y tratamiento de la pérdida de peso
El calcio (Ca2+) es uno de los minerales con posible implicación potencial en la prevención del exceso de peso, debido a su impacto en el depósito de grasa, el metabolismo de los lípidos y la microbiota (85). Los niveles plasmáticos de magnesio (Mg2+) están inversamente asociados con el riesgo de complicaciones metabólicas relacionadas con la obesidad (86). Por otra parte, niveles bajos de zinc (Zn2+) tienen efectos adversos en las funciones fisiológicas y metabólicas de los humanos, especialmente en los procesos fisiopatológicos relacionados con el exceso de peso (87). Algunos efectos del cromo (Cr) en la dieta se han descrito sobre la homeostasis glucídica y posibles beneficios cardiometabólicos (88). La vitamina D está estrechamente relacionada con la exposición solar, la dieta y el metabolismo del calcio (89). La evidencia de estudios observacionales sugiere que patologías asociadas a la RI (obesidad, DMT2, ECV, entre otros) se asocian a niveles bajos de vitamina D (90). Las vitaminas A y C son vitaminas con poder antiinflamatorio, cuya suplementación podría ayudar a mejorar los estados clínicos relacionados con la RI y su prevención (91,92). Algunos micronutrientes y compuestos bioactivos de la dieta, como la vitamina A, la vitamina B6, el selenio, el hierro, el silicio y compuestos polifenólicos, podrían ser de interés en el manejo de la obesidad al tener propiedades antiinflamatorias y/o funciones antioxidantes, además de su posible implicación sobre la modulación del metabolismo lipídico y la microbiota intestinal (88,93–95), aunque los resultados no son concluyentes en algunos casos.
2.1.11 Dietas basadas en fórmulas y sustitución de comidas
Una forma de mejorar la simplicidad y la adherencia dietética es usar porciones controladas de alimentos convencionales o sustitutos de comidas, líquidos o en barras que proporcionen nutrientes en cantidades y calorías predeterminadas (36,46,65). Las dietas prescritas de 1000–1500 kcal/día con alimentos controlados en porciones aumentaron las pérdidas de peso iniciales en 2,5–3,0 kg a los 3–6 meses, en comparación con la prescripción de una dieta autoseleccionada de alimentos convencionales con el mismo objetivo calórico (81,82). Las comidas con porciones controladas, en comparación con las dietas autoseleccionadas, continúan produciendo mayores pérdidas de peso entre los 12 y los 18 meses, aunque ambos enfoques se asocian con una recuperación gradual del peso (81,82).
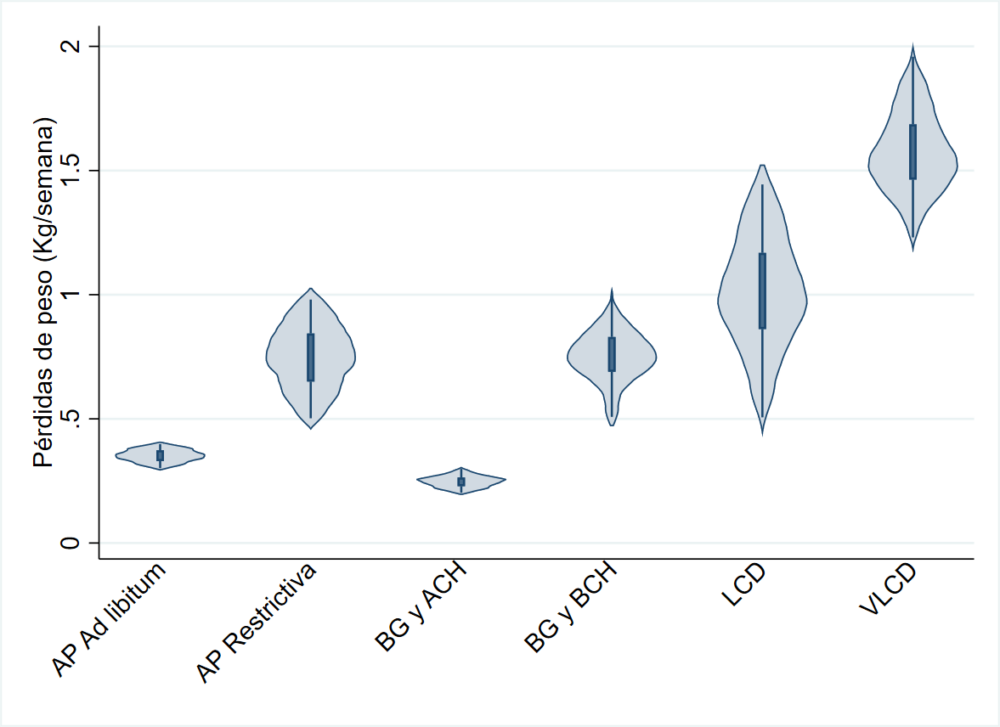
Figura 1: Pérdidas de peso en función de diferentes tipos de dietas para el tratamiento de la obesidad. AP: Alto en Proteínas. BG: Bajo en Grasas. ACH: Alto en Carbohidratos. BCH: Baja en carbohidratos. VLCD: Very Low-Calorie Diet, LCD: Low Calorie Diet, CH: Carbohidratos. Datos simulados basados en la evidencia clínica actual. Elaboración con STATA 15 SE (StataCorp).
2.1.12 Crononutrición: dietas intermitentes y cronorestringidas
La crononutrición considera circadianamente los procesos metabólicos involucrados en la nutrición, con el fin de establecer los momentos de la ingesta del paciente ofertados por el ritmo biológico o una necesidad médica concreta (96–98). Este tipo de dietoterapia para la obesidad tiene como objetivo la pérdida de peso y mejora cardiometabólica mediante el ajuste de la ingesta de alimentos a los ritmos biológicos (99,100), ganando cada día más la atención científica y pública. Aunque existe cierta variedad, estas pautas pueden diferenciarse en dos modelos (101):
Alimentación con restricción de tiempo (TRF, de sus siglas en inglés “time-restricted feeding”): consiste en restringir la ingesta de alimentos a períodos de tiempo específicos del día, generalmente entre 8 y 12 horas de ayuno continuado cada día.
Ayuno intermitente (AI): implica ayunar durante 12 horas o más, con ciclos regulares entre periodos de ayuno y de alimentación; el más conocido es el método 16/8, que consiste en 16 horas de ayuno con 8 horas de alimentación libre.
Ayuno periódico (AP): Involucra periodos de ayunos más prolongados (entre 1 y 3 días por semana), seguidos de 4 a 6 días de alimentación normal “ad libitum” a la semana.
Estas modificaciones dietéticas son capaces de reducir e incluso curar diferentes complicaciones clínicas asociadas con un IMC elevado (102), provocando pérdidas de peso de entre 5 a 9 kg, en un periodo de entre 7-11 semanas, mejorando la funcionalidad insulínica y niveles glucémicos (103), aunque sus beneficios respecto a los regímenes convencionales parecen depender de características individuales. Los resultados actuales evidencian que la restricción energética inducida por estos patrones es la que mayor responde a la reducción de la adiposidad (96).
2.1.13 Dietas populares, pintorescas, engañosas y mágicas
A lo largo de los tiempos se han ido desarrollando diversos tipos de dietas con bastante popularidad, aunque frecuentemente con riesgos asociados para la salud y poca base científica, que se pueden categorizar a grandes rasgos en los siguientes tipos (46, 104):
1) Dietas hipocalóricas nutricionalmente desequilibradas como son:
La dieta de la clínica “Mayo”: Muy baja en calorías y rica en proteínas; restringe grupos alimenticios esenciales.
Dieta “Toma la mitad”: Sin reglas estrictas, solo reducir a la mitad la cantidad de alimentos consumidos.
Dieta gourmet: Basada en la reducción calórica con comidas refinadas y de alta calidad.
Dieta cero: Restricción dietética extrema de alimentos, promoviendo el ayuno total o casi total (104).
Estas dietas provocan un efecto rebote que se traduce en un aumento de masa grasa y pérdida de masa muscular, existiendo una adaptación metabólica a la disminución drástica de la ingesta energética, que se caracteriza fundamentalmente por una disminución del gasto energético. Estos regímenes suelen ser monótonos, además de presentar numerosos déficits en nutrientes, sobre todo si se prolongan por largos períodos de tiempo (44).
2) Dietas disociativas: dieta de Hay o disociada, que se basa en no mezclar proteínas con carbohidratos en una misma comida, como son:
El régimen de Shelton: basado en la combinación adecuada de alimentos para mejorar su digestibilidad. D
ieta Hollywood: Centrada en frutas y prohíbe la combinación de ciertos macronutrientes.
Dieta de Montignac: Clasifica alimentos según su índice glucémico y prohíbe ciertos carbohidratos.
Antidieta: Similar a la disociada, con énfasis en el consumo de frutas en la mañana (44,104).
3) Dietas excluyentes pueden ser:
Ricas en hidratos de carbono, sin lípidos ni proteínas.
Dieta del Dr. Prittikin: baja en grasa y proteínas, con alto consumo de carbohidratos complejos.
Dieta del Dr. Haas: alta en carbohidratos, con exclusión parcial de proteínas y grasas.
Ricas en proteínas y sin hidratos de carbono: dieta de Scardale es alta en proteínas y baja en carbohidratos y grasas; restringe calorías; dieta de los astronautas: alta en proteínas y grasas, con muy pocos carbohidratos; dieta de Hollywood: basada en jugos y batidos proteicos con restricción de carbohidratos; dieta de la proteína líquida: se basa en el consumo exclusivo de proteínas en forma líquida. Su fundamento es que los alimentos no contribuyen al aumento de peso por sí mismos, sino al consumirse según determinadas combinaciones. No limitan la ingesta de alimentos energéticos, sino que pretenden impedir su aprovechamiento como sustrato energético con la disociación (44).
Las dietas excluyentes: se basan en eliminar de la dieta algún nutriente. Estas dietas pueden ser:
Ricas en hidratos de carbono y sin lípidos y proteínas, como la dieta del Dr. Prittikin y la dieta del Dr. Haa.
Ricas en proteínas sin hidratos de carbono: dieta de Scardale, dieta de los astronautas, dieta de Hollywood y dieta de la proteína líquida. Producen una sobrecarga renal y hepática muy importante: dietas solo con proteínas, por ejemplo, la dieta Dukan, en sus dos primeras fases.
Ricas en grasa: dieta de Atkins, dieta de Lutz. Se conocen como dietas cetogénicas. Pueden ser muy peligrosas para la salud, produciendo graves alteraciones en el metabolismo (acidosis, cetosis, aumento de colesterol sanguíneo, etc.) (44).
La dieta de la Zona es otra de las dietas populares que reza en su reclamo: “verduras de colores, pescado rico en ácidos grasos omega-3, como el salmón, y frutas” (44). El método “dieta de la zona” es un régimen hipocalórico, ligeramente hipohidrocarbonado e hiperproteico, donde las relaciones hidratos de carbono/grasa/proteínas suponen el 40%, 30% y 30% de la energía. Los resultados de una variante de esta dieta llamada RESMENA(105) revelaron que algunos marcadores bioquímicos inflamatorios mejoraron.
Aunque las propuestas son muy diferentes y hay distintas clasificaciones, presentan algunas características comunes, como son un aporte energético bajo, que consiguen que se ingieran menos kilocalorías y se intenta justificar de alguna otra forma con distintos fundamentos. No obstante, se olvidan de la ingesta de nutrientes y compuestos bioactivos y de sus consecuencias negativas y, además, no logran corregir unos hábitos alimentarios incorrectos. Los datos sobre el contenido energético de algunas dietas populares “milagro” o de “moda” de amplio seguimiento en el mundo y su comparación con dietas hipocalóricas balanceadas quedan reducidos a continuación (Tabla 3).
Tabla 3. Contenido en energía y perfil calórico de algunos tipos de dietas restrictivas.
2.2 Actividad física y ejercicio programado
La actividad física (AF) es cualquier movimiento corporal sostenido que aumente el gasto de energía, como caminar, bailar, nadar, trabajo físico pesado, etc. (106). El ejercicio es una subcategoría de la actividad física que se planifica, tiene un propósito y se repite regularmente para mejorar o mantener la salud y el estado físico (106,107). Es decir, en la actualidad el gasto por actividad física se subdivide en a) actividad física espontánea o no reglada (NEAT, de las siglas en inglés para Non Exercise Activity Thermogenesis), e incluye la actividad física realizada en transporte activo (andando, subiendo escaleras, yendo en bicicleta, etc.), la actividad laboral, la doméstica y la de ocio; y b) la actividad física reglada, también denominada ejercicio físico o deporte, o EAT, de las siglas en inglés para Exercise Activity Thermogenesis). La actividad física es la parte más variable del gasto energético total y puede oscilar entre un 10% en personas muy sedentarias a más de un 50% en individuos muy activos, siendo por tanto esencial el planteamiento de una actividad física reglada y personalizada en el tratamiento de la obesidad (31).
Los ejercicios se pueden dividir en cuatro tipos principales, aunque estos pueden superponerse, incluyendo:
Ejercicios aeróbicos, diseñados para aumentar la capacidad cardiovascular y respiratoria, como caminar o correr.
Ejercicios de fuerza (o resistencia), diseñados para aumentar la fuerza muscular, como levantamiento de pesas o ejercicios de resistencia con el peso corporal (por ejemplo: dominadas, flexiones, sentadillas).
Ejercicios de equilibrio diseñados para mejorar el equilibrio, como caminar de punta a punta o tai-chi.
Ejercicios de movilidad (o flexibilidad) destinados a mantener o mejorar el rango de movimiento alrededor de una articulación o alargar un músculo, como estiramiento o yoga.
La intensidad del ejercicio físico y la frecuencia son factores clave en el beneficio cardiometabólico de los pacientes. Si bien se logran claramente beneficios para la salud significativos con el ejercicio de intensidad moderada, en un estudio de cohortes con un total de 403.681 participantes con una mediana de seguimiento de 10,1 años, la realización de más de un 50 % de actividad física vigorosa de la actividad física diaria total mostró un 17 % menos de mortalidad por todas las causas (HR de 0,83; IC al 95 %, 0,78-0,88), en comparación con aquellos participantes que no realizaban actividad física intensa (108). Además, se ha descrito que la AF vigorosa mejora la sensibilidad a la insulina a las 2 semanas de inicio en pacientes con RI con y sin exceso de peso (109), de hecho, este tipo de AF tiene una influencia positiva sobre los parámetros asociados con el MetS, como la intolerancia a la glucosa, la hiperinsulinemia, la HTA y la DLP (110). Otro estudio con datos de 11 cohortes en la encuesta de salud de Inglaterra y Escocia (N= 64.913) encontró que la actividad física vigorosa se asoció con una reducción del 16 % mayor en el riesgo de mortalidad por todas las causas, en comparación con la actividad física moderada (111).
La actividad física programada (AFP) junto con la reeducación en los patrones alimenticios, suele ser la primera opción ante un paciente con sobrepeso u obesidad (1,4,6). Aunque las pautas mínimas para la AF aeróbica (150 min/semana de AF moderada o 75 min/semana de AF vigorosa) pueden reducir el riesgo de desarrollar DMT2 y ECV, estos niveles son generalmente inadecuados para una pérdida de peso clínicamente significativa o para mantener el peso sin restricción calórica (112,113). Un metaanálisis indicó que la actividad física da lugar a una pérdida de peso de 1-1,5 kg más en 12 meses que con una intervención dietética compatible con un desequilibrio energético (114). Para mantener el peso a largo plazo, pueden ser necesarios entre 60 y 90 minutos de ejercicio al día (4). En el ensayo Look AHEAD, el aumento de la actividad al año no se mantuvo a los 4 años (grupo intervención), y hubo un aumento de peso después del año 1 en el grupo de intervención, aunque se mantuvieron por debajo de su peso inicial durante un seguimiento de 8 años (114). En un programa para la prevención de DMT2 a través de la actividad física “VP Transform for Prediabetes”, con un total de 1095 voluntarios y un seguimiento de 12 meses, el aumento de la actividad a 90 minutos semanales, redujo un promedio de 4,9 kg (5,5% del basal) (115).
3. CONCLUSIONES
La obesidad es una enfermedad compleja y multifactorial que requiere un enfoque integral, multidisciplinar y personalizado para su manejo efectivo. Dado que más del 80% recupera el peso perdido después de dos años de iniciado el tratamiento (116), parece importante recalcar que la clave contra la obesidad está en la prevención y un arma indiscutible es comer variado, de forma prudente y simultánea, como se hacía en el Mediterráneo hace 60 años, así como mantener el apoyo psicológico a largo plazo. Si presentamos exceso de peso, planteémonos unos objetivos prudentes, pérdidas de peso creíbles y, lo que es más difícil, seamos disciplinados de por vida en la lucha contra la ganancia de peso, comiendo aquello que pertenece a nuestro acervo gastronómico (dietas balanceadas tipo mediterráneo) y huyendo de aquello que no esté dentro de ese esquema (44).
Como es sabido, la obesidad común es una enfermedad poligénica con intervención de muchos genes y la presencia de polimorfismos que limitan o modifican sensiblemente las pérdidas de peso y la eficacia de los tratamientos. Así, por ejemplo, debemos señalar la importancia de polimorfismos de un solo nucleótido (single nucleotide polymorphism o SNP) en genes como el de la obesidad y masa grasa (FTO), receptor 4 de la melanocortina (MC4R), en los cronogenes (CLOCK y BALM-1), perilipina, etc., que modifican y limitan las pérdidas de peso y adiposidad a largo plazo, así como los factores de riesgo cardiovascular (117,118). Aparte de la genética, factores epigenéticos y metagenéticos modifican a su vez los efectos de las dietas, existiendo una variabilidad de respuesta importante de unos individuos a otros (117,119).
La nutrición personalizada basada en tecnologías “ómicas” permite identificar factores genéticos, metabólicos y microbiológicos que influyen en la respuesta individual al tratamiento dietético. La precisión en la intervención nutricional es clave para optimizar la pérdida de peso y mejorar las comorbilidades asociadas. Las dietas hipocalóricas en combinación con un aumento de la actividad física son estrategias fundamentales para la reducción de peso y la mejora del perfil cardiometabólico. Además, los tratamientos farmacológicos, como los agonistas de GLP-1 y GLP-1/GIP, han mostrado eficacia significativa en el control del peso y la reducción del riesgo metabólico en pacientes con obesidad. La prescripción dietética debe considerar las diferentes manifestaciones de la obesidad, adaptando la distribución de macronutrientes y los patrones de alimentación a cada paciente. En este contexto, la medicina de precisión aplicada a la obesidad y sus complicaciones ofrece una oportunidad para mejorar los resultados clínicos mediante intervenciones dirigidas y basadas en evidencia científica. Finalmente, la integración de herramientas “ómicas” en la evaluación y tratamiento de la obesidad permitirá desarrollar estrategias más eficaces y sostenibles en el tiempo, optimizando la respuesta terapéutica y la prevención de complicaciones a largo plazo de forma personalizada y con precisión.
En definitiva, el tratamiento de la obesidad debe considerar una nutrición individual (única y a medida), integrando factores de la historia clínica, exploración física (fenotipo), genética, conductuales, con el apoyo de criterios preventivos personalizados de precisión.
4. REFERENCIAS
- Lin X, Li H. Obesity: Epidemiology, Pathophysiology, and Therapeutics. Front Endocrinol (Lausanne). 2021 Sep 6;12:706978.
- Sanchez Muniz F. Obesity: a very serious public health problem. An la Real Acad Nac Farm. 2016;82(Special Issue):6–26.
- Lecube A, Monereo S, Rubio MÁ, Martínez-de-Icaya P, Martí A, Salvador J, et al. Prevención, diagnóstico y tratamiento de la obesidad. Posicionamiento de la Sociedad Española para el Estudio de la Obesidad de 2016. Endocrinol Diabetes y Nutr. 2017 Mar;64:15–22.
- González-Muniesa P, Mártinez-González M-A, Hu FB, Després J-P, Matsuzawa Y, Loos RJF, et al. Obesity. Nat Rev Dis Prim. 2017 Dec 15;3(1):17034.
- Romero-Gómez M, Escalada J, Noguerol M, Pérez A, Carretero J, Crespo J, et al. Guía de práctica clínica multidisciplinar de manejo de la esteatosis hepática metabólica. Gastroenterol Hepatol. 2025 Apr;502442.
- Heymsfield SB, Wadden TA. Mechanisms, Pathophysiology, and Management of Obesity. N Engl J Med. 2017 Jan 19;376(3):254–66.
- Rosales Ricardo Y. Antropometría en el diagnóstico de pacientes obesos; una revisión. Nutr Hosp. 2012;27(6):1803–9.
- García-Quismondo Fernández A, Monereo S. Metabolically healthy obese vs. metabolically unhealthy obese. Inst España y Real Acad Nac Farm. 2018;(IV y V Cursos Avanzados sobre Obesidad y Síndrome Metabólico. Sánchez-Muniz FJ.):293–303.
- Rubino F, Cummings DE, Eckel RH, Cohen R V, Wilding JPH, Brown WA, et al. Definition and diagnostic criteria of clinical obesity. Lancet Diabetes Endocrinol. 2025 Mar;13(3):221–62.
Obesity [Internet]. [cited 2021 Feb 19]. Available from: https://www.who.int/health-topics/obesity#tab=tab_1 - Finkelstein EA, Khavjou OA, Thompson H, Trogdon JG, Pan L, Sherry B, et al. Obesity and severe obesity forecasts through 2030. Am J Prev Med. 2012 Jun;42(6):563–70.
- Wang YC, McPherson K, Marsh T, Gortmaker SL, Brown M. Health and economic burden of the projected obesity trends in the USA and the UK. Lancet (London, England). 2011;378(9793):815–25.
- World Obesity Federation Global Obesity Observatory [Internet]. [cited 2022 Apr 22]. Available from: https://data.worldobesity.org/
- Ballesteros-Pomar MD, Rodríguez-Urgellés E, Sastre-Belío M, Martín-Lorenzo A, Schnecke V, Segú L, et al. Assessment of the Potential Clinical and Economic Impact of Weight Loss in the Adult Population with Obesity and Associated Comorbidities in Spain. Adv Ther. 2025 Feb 1;42(2):1265–82.
- Ordovas JM, Ferguson LR, Tai ES, Mathers JC. Science and Politics of Nutrition: Personalised nutrition and health. BMJ. 2018;361.
- Nauck MA, Quast DR, Wefers J, Meier JJ. GLP-1 receptor agonists in the treatment of type 2 diabetes – state-of-the-art. Mol Metab. 2021 Apr 1;46.
- Rodriguez PJ, Goodwin Cartwright BM, Gratzl S, Brar R, Baker C, Gluckman TJ, et al. Semaglutide vs Tirzepatide for Weight Loss in Adults With Overweight or Obesity. JAMA Intern Med. 2024 Sep 1;184(9):1056.
- Jastreboff AM, Aronne LJ, Ahmad NN, Wharton S, Connery L, Alves B, et al. Tirzepatide Once Weekly for the Treatment of Obesity. N Engl J Med. 2022 Jul 21;387(3):205–16.
- Campbell JE, Drucker DJ. Pharmacology, physiology, and mechanisms of incretin hormone action. Cell Metab. 2013 Jun 4;17(6):819–37.
- Andreasen CR, Andersen A, Knop FK, Vilsbøll T. Understanding the place for GLP‐1RA therapy: Translating guidelines for treatment of type 2 diabetes into everyday clinical practice and patient selection. Diabetes, Obes Metab. 2021 Sep 14;23(S3):40–52.
- Sánchez Muniz FJ. The “Hollywood drug”: A treatment for obesity and type 2 diabetes, not valid for everyone. An la Real Acad Nac Farm. 2025 Mar 31;(91(01)):7–15.
- Frias JP, Deenadayalan S, Erichsen L, Knop FK, Lingvay I, Macura S, et al. Efficacy and safety of co-administered once-weekly cagrilintide 2·4 mg with once-weekly semaglutide 2·4 mg in type 2 diabetes: a multicentre, randomised, double-blind, active-controlled, phase 2 trial. Lancet. 2023 Aug;402(10403):720–30.
- Van Namen M, Prendergast L, Peiris C. Supervised lifestyle intervention for people with metabolic syndrome improves outcomes and reduces individual risk factors of metabolic syndrome: A systematic review and meta-analysis. Metabolism. 2019 Dec 1;101.
- Huttunen-Lenz M, Hansen S, Christensen P, Larsen TM, Sandø-Pedersen F, Drummen M, et al. PREVIEW study—Influence of a behavior modification intervention (PREMIT) in over 2300 people with pre-diabetes: Intention, self-efficacy and outcome expectancies during the early phase of a lifestyle intervention. Psychol Res Behav Manag. 2018;11:383–94.
- Verduci E, Banderali G, Di Profio E, Vizzuso S, Zuccotti G, Radaelli G. Effect of individual- versus collective-based nutritional-lifestyle intervention on the atherogenic index of plasma in children with obesity: a randomized trial. Nutr Metab (Lond). 2021 Dec 1;18(1).
- Ramos-Lopez O, Milagro FI, Riezu-Boj JI, Martinez JA. Epigenetic signatures underlying inflammation: an interplay of nutrition, physical activity, metabolic diseases, and environmental factors for personalized nutrition. Inflammation Research. 2021 Jan 1;70(1):29–49.
- Martinez JA, Navas-Carretero S, Saris WHM, Astrup A. Personalized weight loss strategies – The role of macronutrient distribution. Nature Reviews Endocrinology. 2014;10(12):749–60.
- San-Cristobal R, Navas-Carretero S, Martínez-González MÁ, Ordovas JM, Martínez JA. Contribution of macronutrients to obesity: implications for precision nutrition. Nat Rev Endocrinol. 2020 Jun;16(6):305–20.
- Sánchez Muniz FJ, Sanz Pérez B. Diet and hydration in obesity prevention and treatment. An la Real Acad Nac Farm. 2016;82(special issue):106–28.
- Salas-Salvadó J, Díaz-López A, Ruiz-Canela M, Basora J, Fitó M, Corella D, et al. Effect of a lifestyle intervention program with energy-restricted Mediterranean diet and exercise on weight loss and cardiovascular risk factors: One-year results of the PREDIMED-Plus trial. Diabetes Care. 2019 May 1;42(5):777–88.
- Escobar Toledano D, Pascual Calonge S, González-Gross M. Energy expenditure: Something more than balance. Inst España y Real Acad Nac Farm Madrid. 2018;(IV y V Cursos Avanzados sobre Obesidad y Síndrome Metabólico. Sánchez-Muniz FJ.):65–86.
- Müller MJ, Enderle J, Bosy-Westphal A. Changes in Energy Expenditure with Weight Gain and Weight Loss in Humans. Curr Obes Rep. 2016 Dec 1;5(4):413–23.
- Hall KD, Guo J. Obesity Energetics: Body Weight Regulation and the Effects of Diet Composition. Gastroenterology. 2017 May 1;152(7):1718-1727.e3.
- Lee EY, Yoon KH. Epidemic obesity in children and adolescents: risk factors and prevention. Front Med. 2018 Dec 1;12(6):658–66.
- Nguyen B, Clements J. Obesity management among patients with type 2 diabetes and prediabetes: a focus on lifestyle modifications and evidence of antiobesity medications. Expert Rev Endocrinol Metab. 2017 Sep 3;12(5):303–13.
- Chao AM, Quigley KM, Wadden TA. Dietary interventions for obesity: clinical and mechanistic findings. J Clin Invest. 2021 Jan 4;131(1).
- Mozaffarian D, Hao T, Rimm EB, Willett WC, Hu FB. Changes in diet and lifestyle and long-term weight gain in women and men. N Engl J Med. 2011 Jun 23;364(25):2392–404.
- Royo-Bordonada MÁ, Rodríguez-Artalejo F, Bes-Rastrollo M, Fernández-Escobar C, González CA, Rivas F, et al. Políticas alimentarias para prevenir la obesidad y las principales enfermedades no transmisibles en España: querer es poder. Gac Sanit. 2019 Nov;33(6):584–92.
- Lal A, Mantilla-Herrera AM, Veerman L, Backholer K, Sacks G, Moodie M, et al. Correction: Modelled health benefits of a sugar-sweetened beverage tax across different socioeconomic groups in Australia: A cost-effectiveness and equity analysis. PLoS Med. 2020 Jul 1;17(7).
- Mayor-Zaragoza F, Bastida S, Sánchez-Muniz F. El papel de los medios en la obesidad. Instituto de España. Real Academia Nacional de Farmacia. Madrid; 2018. 45-63. p.
- FAO. Food-based dietary guidelines – Spain. [Internet]. Available from: https://www.fao.org/nutrition/education/food-dietary-guidelines/regions/spain/previous-versions/zh/
- Pilar Vaquero M, Martínez-Suárez M, García-Quismondo Á, del Cañizo FJ, Sánchez-Muniz FJ. Diabesity negatively affects transferrin saturation and iron status. The DICARIVA study. Diabetes Res Clin Pract. 2021 Feb;172:108653.
- Sánchez Muniz F. Obesity a key component of the metabolic syndrome. Instituto de España. Real Academia Nacional de Farmacia. Madrid; 2018. 17–44 p.
- Sánchez-Muniz F. Dietas milagro. Ventajas e inconvenientes. Instituto de España. Real Academia Nacional de España. Madrid; 2015. ebook.
- Bretón Lesmes I. Fad diets for obesity treatment: a critical review. An la Real Acad Nac Farm. 2016;82:195–205.
- Marques-Lopes I, Russolillo G, Lopes-Rosado E, Bressan J. Dietas adelgazantes. An Sist Sanit Navar. 2002;25(SUPPL. 1):163–73.
- Jensen MD, Ryan DH, Apovian CM, Ard JD, Comuzzie AG, Donato KA, et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: A report of the American college of cardiology/American heart association task force on practice guidelines and the obesity society. J Am Coll Cardiol. 2014 Jul 1;63(25 PART B):2985–3023.
- MD J, DH R, CM A, JD A, AG C, KA D, et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. Circulation. 2014 Jun 24;129(25 Suppl 2).
- Parretti HM, Jebb SA, Johns DJ, Lewis AL, Christian-Brown AM, Aveyard P. Clinical effectiveness of very-low-energy diets in the management of weight loss: a systematic review and meta-analysis of randomized controlled trials. Obes Rev. 2016 Mar 1;17(3):225–34.
- Verdich C, Barbe P, Petersen M, Grau K, Ward L, Macdonald I, et al. Changes in body composition during weight loss in obese subjects in the NUGENOB study: Comparison of bioelectrical impedance vs. dual-energy X-ray absorptiometry. Diabetes Metab. 2011 Jun;37(3):222–9.
- Dietry Guidlines for Americans 2015-2020. U.S. Department of Health and Human Services and U.S. Department of Agriculture. . Diet Guidel Am 8th Ed. 2015 Dec;(8th Edition).
- Rubio Herrera M. Dietoterapia de la obesidad. Ventajas y riesgos cardiometabólicos. Real Acad Nac Farm. (VIII Curso Avanzado sobre obesidad Obesidad y Cardiometabolismo. Abordaje holístico.).
- San-Cristobal R, Navas-Carretero S, Martínez-González MÁ, Ordovas JM, Martínez JA. Contribution of macronutrients to obesity: implications for precision nutrition. Nat Rev Endocrinol. 2020 Jun 1;16(6):305–20.
- Larsen TM, Dalskov S-M, van Baak M, Jebb SA, Papadaki A, Pfeiffer AFH, et al. Diets with High or Low Protein Content and Glycemic Index for Weight-Loss Maintenance. N Engl J Med.
- 2010 Nov 25;363(22):2102–13.
- Chamorro R, Kannenberg S, Wilms B, Kleinerüschkamp C, Meyhöfer S, Park SQ, et al. Meal Timing and Macronutrient Composition Modulate Human Metabolism and Reward-Related Drive to Eat. Nutrients. 2022 Feb 1;14(3).
- Moon J, Koh G. Clinical Evidence and Mechanisms of High-Protein Diet-Induced Weight Loss. J Obes Metab Syndr. 2020 Sep 30;29(3):166–73.
- Hession M, Rolland C, Kulkarni U, Wise A, Broom J. Systematic review of randomized controlled trials of low-carbohydrate vs. low-fat/low-calorie diets in the management of obesity and its comorbidities. Obes Rev. 2009 Jan;10(1):36–50.
- Naude CE, Brand A, Schoonees A, Nguyen KA, Chaplin M, Volmink J. Low-carbohydrate versus balanced-carbohydrate diets for reducing weight and cardiovascular risk. Cochrane Database Syst Rev. 2022 Jan 28;2022(1).
- Chao A, Quigley K, Wadden T. Dietary interventions for obesity: clinical and mechanistic findings. J Clin Invest. 2021 Jan 4;131(1).
- Kim D. Glycemic index. In: Obesity. Amsterdam: Elsevier; 2020. p. 183–9.
- Atkinson FS, Brand-Miller JC, Foster-Powell K, Buyken AE, Goletzke J. International tables of glycemic index and glycemic load values 2021: a systematic review. Am J Clin Nutr. 2021 Nov;114(5):1625–32.
- Brouns F, Bjorck I, Frayn KN, Gibbs AL, Lang V, Slama G, et al. Glycaemic index methodology. Nutr Res Rev. 2005 Jun 16;18(1):145–71.
- Björck I, Granfeldt Y, Liljeberg H, Tovar J, Asp N. Food properties affecting the digestion and absorption of carbohydrates. Am J Clin Nutr. 1994 Mar;59(3):699S-705S.
- Onna Lo YM. Glycemic Index and Glycemic Load. In: Integrative Medicine. Elsevier; 2018. p. 863-868.e1.
- Labayen I, Martínez JA. Distribución de macronutrientes de la dieta y regulación del peso y composición corporal: Papel de la ingesta lipídica en la obesidad. An Sist Sanit Navar. 2002;25(SUPPL. 1):79–90.
- Zafar MI, Mills KE, Zheng J, Peng MM, Ye X, Chen LL. Low glycaemic index diets as an intervention for obesity: a systematic review and meta-analysis. Obes Rev. 2019 Feb 1;20(2):290–315.
- Schwingshackl L, Hoffmann G. Long-term effects of low glycemic index/load vs. high glycemic index/load diets on parameters of obesity and obesity-associated risks: a systematic review and meta-analysis. Nutr Metab Cardiovasc Dis. 2013 Aug;23(8):699–706.
- Zafar MI, Mills KE, Zheng J, Regmi A, Hu SQ, Gou L, et al. Low-glycemic index diets as an intervention for diabetes: a systematic review and meta-analysis. Am J Clin Nutr. 2019 Oct 1;110(4):891–902.
- Raben A, Astrup A, Vasilaras TH, Prentice AM, Zunft HJF, Formiguera X, et al. CARMEN-studiet: Øget indtagelse af kulhydrater – simple eller komplekse – og nedsat fedtindtagelse giver moderat vœgttab og uœndrede blodlipider hos overvœgtige. Ugeskr Laeger. 2002 Jan 28;164(5):627–31.
- Reynolds AN, Akerman AP, Mann J. Dietary fibre and whole grains in diabetes management: Systematic review and meta-analyses. PLoS Med. 2020 Mar 1;17(3):e1003053.
- Livesey G, Taylor R, Livesey HF, Buyken AE, Jenkins DJA, Augustin LSA, et al. Dietary Glycemic Index and Load and the Risk of Type 2 Diabetes: Assessment of Causal Relations. Nutrients. 2019 Jun 25;11(6):1436.
- Foster-Powell K, Holt SHA, Brand-Miller JC. International table of glycemic index and glycemic load values: 2002. Am J Clin Nutr. 2002;76(1):5–56.
- Salmerón J. Dietary Fiber, Glycemic Load, and Risk of Non—insulin-dependent Diabetes Mellitus in Women. JAMA J Am Med Assoc. 1997 Feb 12;277(6):472.
- Brand-Miller JC, Holt SHA, Pawlak DB, McMillan J. Glycemic index and obesity. Am J Clin Nutr. 2002 Jul;76(1):281S-5S.
- Perin L, Camboim IG, Lehnen AM. Low glycaemic index and glycaemic load diets in adults with excess weight: Systematic review and meta‐analysis of randomised clinical trials. J Hum Nutr Diet. 2022 Dec;35(6):1124–35.
- Aller EEJG, Larsen TM, Claus H, Lindroos AK, Kafatos A, Pfeiffer A, et al. Weight loss maintenance in overweight subjects on ad libitum diets with high or low protein content and glycemic index: the DIOGENES trial 12-month results. Int J Obes (Lond). 2014 Dec 11;38(12):1511–7.
- Wycherley TP, Moran LJ, Clifton PM, Noakes M, Brinkworth GD. Effects of energy-restricted high-protein, low-fat compared with standard-protein, low-fat diets: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2012 Dec 1;96(6):1281–98.
- Schwingshackl L, Hoffmann G. Long-term effects of low-fat diets either low or high in protein on cardiovascular and metabolic risk factors: a systematic review and meta-analysis. Nutr J. 2013;12(1).
- Hansen TT, Astrup A, Sjödin A. Are dietary proteins the key to successful body weight management? A systematic review and meta-analysis of studies assessing body weight outcomes after interventions with increased dietary protein. Nutrients. 2021 Sep 1;13(9).
- Weijs PJM. Protein requirement in obesity. Curr Opin Clin Nutr Metab Care. 2025;28(1).
- Diabetes Prevention Program (DPP) Research Group. The Diabetes Prevention Program (DPP): description of lifestyle intervention. Diabetes Care. 2002 Dec;25(12):2165–71.
- Ryan D, Espeland M, Foster G, Haffner S, Hubbard V, Johnson K, et al. Look AHEAD (Action for Health in Diabetes): design and methods for a clinical trial of weight loss for the prevention of cardiovascular disease in type 2 diabetes. Control Clin Trials. 2003 Oct;24(5):610–28.
- Wadden TA. The look AHEAD study: A description of the lifestyle intervention and the evidence supporting it. Obesity. 2006 May;14(5):737–52.
- Wadden TA. Eight-year weight losses with an intensive lifestyle intervention: the look AHEAD study. Obesity (Silver Spring). 2014 Jan;22(1):5–13.
- Daley DK, Myrie SB. Extra-skeletal effects of dietary calcium: Impact on the cardiovascular system, obesity, and cancer. Adv Food Nutr Res. 2021 Jan 1;96:1–25.
- Piuri G, Zocchi M, Porta M Della, Ficara V, Manoni M, Zuccotti GV, et al. Magnesium in Obesity, Metabolic Syndrome, and Type 2 Diabetes. Nutrients. 2021 Feb 1;13(2):1–17.
- Rios-Lugo MJ, Madrigal-Arellano C, Gaytán-Hernández D, Hernández-Mendoza H, Romero-Guzmán ET. Association of Serum Zinc Levels in Overweight and Obesity. Biol Trace Elem Res. 2020 Nov 1;198(1):51–7.
- Padron-Monedero A, Rodríguez-Artalejo F, Lopez-Garcia E. Dietary micronutrients intake and plasma fibrinogen levels in the general adult population. Sci Rep. 2021 Dec 1;11(1).
- Grossman S, Porth M C. Porth’s Pathophysiology: Concepts of Altered Health States – Sheila Grossman. Ninth.
- Moazzami B, Chaichian S, Kasaeian A, Djalalinia S, Akhlaghdoust M, Eslami M, et al. Metabolic risk factors and risk of Covid-19: A systematic review and meta-analysis. Tan W, editor. PLoS One. 2020 Dec 15;15(12):e0243600.
- Di Vincenzo A, Tana C, El Hadi H, Pagano C, Vettor R, Rossato M. Antioxidant, Anti-Inflammatory, and Metabolic Properties of Tocopherols and Tocotrienols: Clinical Implications for Vitamin E Supplementation in Diabetic Kidney Disease. Int J Mol Sci. 2019 Oct 2;20(20).
- El-Aal AA, El-Ghffar EAA, Ghali AA, Zughbur MR, Sirdah MM. The effect of vitamin C and/or E supplementations on type 2 diabetic adult males under metformin treatment: A single-blinded randomized controlled clinical trial. Diabetes Metab Syndr. 2018 Jul 1;12(4):483–9.
- Macho-González A, Garcimartín A, López-Oliva M, Ruiz-Roso B, Martín de la Torre I, Bastida S, et al. Can Carob-Fruit-Extract-Enriched Meat Improve the Lipoprotein Profile, VLDL-Oxidation, and LDL Receptor Levels Induced by an Atherogenic Diet in STZ-NAD-Diabetic Rats? Nutrients. 2019 Feb 3;11(2):332.
- Garcimartín A, Santos-López JA, Bastida S, Benedí J, Sánchez-Muniz FJ. Silicon-Enriched Restructured Pork Affects the Lipoprotein Profile, VLDL Oxidation, and LDL Receptor Gene Expression in Aged Rats Fed an Atherogenic Diet1–3. J Nutr. 2015 Sep;145(9):2039–45.
- Garcimartín A, Merino JJ, Santos-López JA, López-Oliva ME, González MP, Sánchez-Muniz FJ, et al. Silicon as neuroprotector or neurotoxic in the human neuroblastoma SH-SY5Y cell line. Chemosphere. 2015 Sep;135:217–24.
- Hawley JA, Sassone-Corsi P, Zierath JR. Chrono-nutrition for the prevention and treatment of obesity and type 2 diabetes: from mice to men. Diabetologia. 2020 Nov 1;63(11):2253–9.
- Kessler K, Pivovarova-Ramich O. Meal Timing, Aging, and Metabolic Health. Int J Mol Sci. 2019 Apr 2;20(8).
- Wehrens SMT, Christou S, Isherwood C, Middleton B, Gibbs MA, Archer SN, et al. Meal Timing Regulates the Human Circadian System. Curr Biol. 2017 Jun 19;27(12):1768-1775.e3.
- Flanagan A, Bechtold DA, Pot GK, Johnston JD. Chrono-nutrition: From molecular and neuronal mechanisms to human epidemiology and timed feeding patterns. J Neurochem. 2021 Apr 1;157(1):53–72.
- Katsi V, Papakonstantinou IP, Soulaidopoulos S, Katsiki N, Tsioufis K. Chrononutrition in Cardiometabolic Health. J Clin Med. 2022 Jan 7;11(2).
- Anton SD, Moehl K, Donahoo WT, Marosi K, Lee SA, Mainous AG, et al. Flipping the Metabolic Switch: Understanding and Applying Health Benefits of Fasting. Obesity (Silver Spring). 2018 Feb 1;26(2):254.
- Fanti M, Mishra A, Longo VD, Brandhorst S. Time-Restricted Eating, Intermittent Fasting, and Fasting-Mimicking Diets in Weight Loss. Curr Obes Rep. 2021 Jun 1;10(2):70–80.
- Furmli S, Elmasry R, Ramos M, Fung J. Therapeutic use of intermittent fasting for people with type 2 diabetes as an alternative to insulin. BMJ Case Rep. 2018;2018.
- Martínez Hernandez A. Nutrición saludable frente a la Obesidad. 1a edición. Madrid: Editorial Médica Panamericana.; 2014.
de la Iglesia R, Lopez-Legarrea P, Abete I, Bondia-Pons I, Navas-Carretero S, Forga L, et al. A new dietary strategy for long-term treatment of the metabolic syndrome is compared with the - American Heart Association (AHA) guidelines: the MEtabolic Syndrome REduction in NAvarra (RESMENA) project. Br J Nutr. 2014 Feb 28;111(4):643–52.
- Thompson PD, Arena R, Riebe D, Pescatello LS. ACSM’s new preparticipation health screening recommendations from ACSM’s guidelines for exercise testing and prescription, ninth edition. Curr Sports Med Rep. 2013 Jul;12(4):215–7.
- Wingood M, Bonnell L, LaCroix AZ, Rosenberg D, Walker R, Bellettiere J, et al. Community-Dwelling Older Adults and Physical Activity Recommendations: Patterns of Aerobic, Strengthening, and Balance Activities. J Aging Phys Act. 2021 Aug 1;30(4):653–65.
- Wang Y, Nie J, Ferrari G, Rey-Lopez JP, Rezende LFM. Association of Physical Activity Intensity With Mortality: A National Cohort Study of 403 681 US Adults. JAMA Intern Med. 2021 Feb 1;181(2):203–11.
- Clamp LD, Hume DJ, Lambert E V, Kroff J. Enhanced insulin sensitivity in successful, long-term weight loss maintainers compared with matched controls with no weight loss history. Nutr Diabetes. 2017 Jun 19;7(6):e282.
- Imierska M, Kurianiuk A, Błachnio-Zabielska A. The Influence of Physical Activity on the Bioactive Lipids Metabolism in Obesity-Induced Muscle Insulin Resistance. Biomolecules. 2020 Dec 12;10(12):1665.
- Rey Lopez JP, Gebel K, Chia D, Stamatakis E. Associations of vigorous physical activity with all-cause, cardiovascular and cancer mortality among 64 913 adults. BMJ open Sport Exerc Med. 2019 Aug 1;5(1).
- Elagizi A, Kachur S, Carbone S, Lavie CJ, Blair SN. A Review of Obesity, Physical Activity, and Cardiovascular Disease. Curr Obes Rep. 2020 Dec 1;9(4):571–81.
- Wift DL, McGee JE, Earnest CP, Carlisle E, Nygard M, Johannsen NM. The Effects of Exercise and Physical Activity on Weight Loss and Maintenance. Prog Cardiovasc Dis. 2018 Jul 1;61(2):206–13.
- Wu T, Gao X, Chen M, Van Dam RM. Long-term effectiveness of diet-plus-exercise interventions vs. diet-only interventions for weight loss: a meta-analysis. Obes Rev. 2009 May;10(3):313–23.
- Batten R, Alwashmi MF, Mugford G, Nuccio M, Besner A, Gao Z. A 12-Month Follow-Up of the Effects of a Digital Diabetes Prevention Program (VP Transform for Prediabetes) on Weight and Physical Activity Among Adults With Prediabetes: Secondary Analysis. JMIR diabetes. 2022 Jan 1;7(1).
- Laquatra I. Nutrición para el control de peso. In: Nutrición y dietoterapia de, KRAUSE Mahan LK y Escott-Stump McGraw Hill 10a ed. México; 2001. p. 527–60.
- Keller M, Svensson SIA, Rohde-Zimmermann K, Kovacs P, Böttcher Y. Genetics and Epigenetics in Obesity: What Do We Know so Far? Curr Obes Rep. 2023 Oct 11;12(4):482–501.
- González-Quijano GK, León-Reyes G, Rosado EL, Martínez JA, de Luis DA, Ramos-Lopez O, et al. Effect of Genotype on the Response to Diet in Cardiovascular Disease—A Scoping Review. Healthcare. 2024 Nov 16;12(22):2292.
- Martínez Hernández J. Dietas de Precisión en la Prevención y Tratamiento de la Obesidad. Madrid: VIII Curso Avanzado sobre obesidad Obesidad y Cardiometabolismo. Abordaje holístico. Real Academia Nacional de Farmacia.; 2025.